-
Gebiet der
Erfindung
-
Die
vorliegende Erfindung betrifft in-vitro-Verfahren zur Durchmusterung
von menschlichen Testpersonen, um deren Risiko zur Entwicklung von
Gebärmutterhalskrebs
zu bestimmen.
-
Hintergrund
der Erfindung
-
Gebärmutterhalskrebs
ist eine der am häufigsten
vorkommenden malignen Erkrankungen weltweit und stellt eine der
Haupttodes- und Mortalitätsursachen
bei Frauen dar (Parkin DM, Pisani P, Ferlay J (1993) Int J Cancer
54: 594-606; Pisani P, Parkin DM, Ferlay J (1993) Int J Cancer 55:
891-903). 15.700 neue Fälle eines
invasiven Gebärmutterhalskrebses
wurden in den Vereinigten Staaten 1996 vorhergesagt, und das jährliche
weltweite Vorkommen wird durch die Weltgesundheitsorganisation auf
450.000 geschätzt
(1990). Die jährliche
Vorkommensrate unterscheidet sich in unterschiedlichen Teilen der
Welt in einem Bereich von 7,6 pro 100.000 in Westasien bis 46,8
pro 100.000 in Südafrika
(Parkin et al., 1993 ibid).
-
Die
gegenwärtige
Konzeption von Gebärmutterhalskrebs
besteht darin, dass es sich um eine Krankheit mit mehreren Stadien
handelt, die sich regelmäßig über einen
Zeitraum von 10 bis 25 Jahren entwickelt. Ein invasives Plattenepithelkarzinom
der Gebärmutter
entfaltet sich durch eine Penetration durch die basale Lamina und
einem Eindringen der Stroma oder der epithelialen Lamina-Propria.
Der klinische Verlauf eines Gebärmutterhalskrebses
zeigt eine beträchtliche
Variation. Die Prognose wurde auf das klinische Stadium, Lymphknotenentwicklung,
primäre
Tumormasse, histologischer Typ, Invasionstiefe und lymphatische
Permeation gerichtet (Delgado G et al., (1990) Gynecol Oncol 38:
352-357). Einige Patienten mit weniger günstigen Tumoreigenschaften
besitzen eine relativ gute Entwicklung, während andere an einer fatalen
Entwicklung einer anfangs eingeschränkten Krankheit leiden. Dies
zeigt einen klaren Bedarf an zusätzlichen
Markern, um neu diagnostizierte Gebärmutterhalskarzinome weiter
zu charakterisieren, um eine risikoangepasste Therapie zu verabreichen
(Ikenberg H et al., Int. J. Cancer 59:322-6. 1994).
-
Die
Epidemiologie von Gebärmutterhalskrebs
hat eine starke Verbindung mit religiösen, familiären und sexuellen Mustern gezeigt.
In beinahe 100 Fallkontrollstudien wurde die Beziehung zwischen
HPV und einer zervikalen Neoplasie untersucht, und beinahe alle
fanden positive Verbindungen (IARC Monographen, 1995). Die Verbindung
ist stark, andauernd und spezifisch auf eine beschränkte Anzahl
von viralen Typen (Munoz N, Bosch FX (1992) HPV and cervical neoplasia:
review of case-control and cohort studies. IARC Sci PubI 251-261).
Unter den am meisten informativen Studien wurden starke Verbindungen
mit HPV 16 DNA mit bemerkenswerter Konsistenz für invasiven Krebs und hochgradige
CIN-Läsionen
beobachtet, was die Möglichkeit
ausschließt,
dass diese Verbindung durch Zufall, Vorbestimmung oder Verwechslung
erklärt
werden kann (IARC Monographen, 1995). Ein indirekter Beweis legt
nahe, dass in Krebszellen nachgewiesene HPV-DNA einen guten Marker
für die
Rolle einer HPV-Infektion
in der frühen
Karzinogenese darstellt. Es wurde eine Dosis-Antwort-Beziehung zwischen
einer zunehmenden viralen Beladung und dem Risiko von Gebärmutterhalskrebs
berichtet (Munoz und Bosch, 1992 ibid). In einigen größeren Reihen
waren bis zu 100 % der Tumore positiv auf HPV, jedoch ist das Vorkommen
von Virus-negativen Gebärmutterhalskarzinomen
noch immer debattierbar (Meijer CJ et al., (1992) Detection of human
papillomavrius in cervical scrapes by the polymerase chain reaction
in relation to cytology: possible implications for cervical cancer
screening. IARC Sci PubI 271-281; Das BC, et al., (1993) Cancer
72: 147-153).
-
Die
am häufigsten
vorkommenden HPV-Arten, die in Plattenepithel-Gebärmutterhals-Karzinomen gefunden
wurden, sind HPV 16 (41%-86%) und 18 (2%-22%). Zusätzlich werden
auch HPV 31, 33, 35, 39, 45, 51, 52, 54, 56, 58, 59, 61, 66 und
68 gefunden (IARC, Monographen, 1995), Auf der HPV 2000 Internationalen Konferenz
in Barcelona wurden HPV 16, 18, 31 und 45 als hoch-risikoreich definiert,
während
HPV 33, 35, 39, 51, 52, 56, 58, 59, 68 als mittel-risikoreich definiert
wurden (Keerti V. Shah. P71). Die 13 HPV mit hohem und mittlerem
Risiko werden zusammen oft als Krebs-assoziierte HPV-Arten bezeichnet.
-
Eine
Anzahl von Studien hat die potentielle Rolle eines HPV-Testes für ein zervikales
Screening untersucht (s. Cuzick et al. A systematic review of the
role of human papillomavrius testing withing a cervical screening
programme. Health Technol Assess 3:14. 1999).
-
Reid
et al., (Reid R, et al., (1991) Am J Obstet Gynecol 164: 1461-1469)
waren die Ersten, die eine Rolle für einen HPV-Test in einem Screening-Zusammenhang
demonstrierten. Diese Studie wurde an Frauen mit hohem Risiko von
sexuell übertragenen
Krankheitsverläufen
mit spezialisierten Gynäkologen
durchgeführt, die
eine empfindliche (niedrig stringente) Southern Blot-Hybridisierung
zur HPV-Detektion verwendeten. Insgesamt waren 1012 Frauen eingeschrieben,
und eine Zervikographie wurde auch als mögliche Ergänzung zur Zytologie in Erwägung gezogen.
23 CIN II/III-Läsionen
wurden insgesamt gefunden, jedoch wurden lediglich 12 durch Zytologie
nachgewiesen (Sensitivität
52 %, Spezifität
92 %). Der HPV-Test hat 16 hochgrädige Läsionen gefunden.
-
Bauer
et al. (Bauer HM, et al., (1991) JAMA 265: 472-477) berichten über eine
frühere
PCR-basierte Studie unter Verwendung von MY09/11-Primern (Manos
M, et al., (1990) Lancet 335: 734) in jungen Frauen, die an Routine-Abstrichen
teilnahmen (Universitätsstudentinnen).
Sie fanden eine positive Rate von 46 % in 467 Frauen, die wesentlich
höher war
als in einem Dot-Blot-Assay (11 %).
-
In
einer unter Einsatz von PCR durchgeführten Studie mit GP5/6-Primern
(Van Den Brule AJ, et al., (1990) J Clin Microbiol 28: 2739-2743)
van der Brule et al. (Van Den Brule AJ, et al., (1991) Int J Cancer
48: 404-408) wurde eine sehr starke Korrelation von positiven HPV
mit einer zervikalen Neoplasie gezeigt, was anhand einer Zytologie
bestimmt wurde. In älteren
Frauen (in einem Alter von 35 bis 55 Jahren) betrug die positive
HPV-Rate durch negative Zytologie lediglich 3,5 %, und diese war
auf 1,5 % vermindert, wenn nur die Arten 16, 18, 31 und 33 herangezogen
wurden, während
Frauen mit einem histologischen Karzinom in situ alle HPV-positiv
waren, und 90 % hatten eine der vier oben genannten Arten. Frauen
mit weniger schweren zytologischen Abnormalitäten hatten niedrigere positive
HPV-Raten in einem abgestuften Weg und zeigten einen klaren Trend.
-
Roda
Housman et al. (Roda Housman AM, et al., (1994) Int J Cancer 56:
802-806) erweiterte diese Beobachtungen, indem sie auf weitere 1.373
Frauen mit abnormalen Abstrichen schaute. Diese Studie bestätigte auch
die zunehmende positive Rate mit zunehmender Schwere der Abstrichergebnisse.
Sie bemerkten auch, dass das Niveau der HPV-Heterogenität auf 22
Typen von niedriggradigen Abstrichen auf 10 "Hochrisiko"-Typen bei hochgradigen Abstrichen absank.
Dieses Dokument enthielt keine zytologisch negativen Frauen, noch
wurde eine zytologische Krankheit histologisch bestätigt.
-
Cuzick
et al. (Cuzick J, et al., (1992) Lancet 340: 112-113; Cuzick J,
et al., (1994) Br J Cancer 69: 167-171) waren die Ersten, die berichteten,
dass ein HPV-Test nützliche
Informationen zur Sichtung zytologischer Anormalitäten während eines
zufälligen
Screenings lieferte. In einer Studie mit 133 Frauen mit Verweis auf
eine Koloposkopie fanden sie einen positiven Prognosewert von 42
%, der ähnlich
dem einer moderaten Dyskaryose war. Die Ergebnisse waren umso auffälliger für HPV 16,
wo 39 von 42 HPV 16-positiven Frauen eine hochgradige CIN bei der
Biopsie zeigten. Diese Studie stellte die Wichtigkeit der Bestimmung
einer viralen Belastung dar und erachtete lediglich hohe Niveaus
von Hochrisiko-Arten als positiv.
-
Cox
et al. (Cox JT, et al., (1995) Am J Obstet Gynecol 172: 946-954)
demonstrierten eine Rolle für
einen HPV-Test unter Verwendung des Hybrid CaptureTM Systems
(DIGENE Corporation, Gaithersburg, MD, USA) zur Sichtung von Frauen
mit grenzwertigen Abstrichen. Dieser Test wurde mit 217 Frauen von
einem Universitätsvermittlungsdienst
durchgeführt,
und es wurde eine Empfindlichkeit von 93 % für CINII/III festgestellt im
Vergleich zu 73 % einer wiederholten Zytologie. Es wurde eine hohe
virale Belastung festgestellt, welche die Leistung weiter verbesserte,
indem Falsch-Positive vermindert wurden. Wenn 5 RLU als Ausschlusswert
genommen wurden, wurde eine PPV von ungefähr 24 % ohne Empfindlichkeitsverlust
festgestellt.
-
Cuzick
et al. (Cuzick J, et al., (1995) Lancet 345: 1533-1536) etablierten
einen HPV-Test in einem primären
Screening-Kontext in 1.985 Frauen, die an einem Routine-Screening
bei einer Familienplanungsklinik teilnahmen. Die Empfindlichkeit
bei Verwendung einer Artenspezifischen PCR für die vier häufig vorkommenden
HPV-Arten (75 %) war größer als
die der Zytologie (46 %), und der PPV für einen positiven HPV-Test
(42 %) entsprach in etwa dem einer moderaten Dyskaryose (43 %).
-
WO
91/08312 beschreibt Verfahren zur Bestimmung der Prognose von Individuen,
die, mit HPV infiziert sind, umfassend das Messen der HPV-Aktivitätsspiegel
durch eine Detektion von Transkripten des gesamten oder eines Teils
der E6 und/oder E7-HPV-Gene in einer Probe und Vergleichen der Messungen
der HPV-Aktivität
mit einer zuvor etablierten Beziehung zwischen Aktivität und dem
Risiko einer Entwicklung eines ernsten zervikalen Dysplasie oder
eines Karzinoms.
-
WO
99/29890 beschreibt Verfahren für
die Bestimmung einer HPV-Infektion basierend auf der Messung und
Analyse der Genexpressionsspiegel. Insbesondere beschreibt WO 99/29890
Verfahren, die auf der Messung der Expressionsspiegel von zwei oder
mehreren HPV-Genen (z.B. HPV E6, E7, L1 und E2) und anschließendes Vergleichen
des Expressionsverhältnisses
von Kombinationen dieser Gene basieren, um einen Hinweis auf das
Stadium der HPV-basierenden
Krankheit in einem Patienten zu geben.
-
EP-A-0
662 518 (AMOCO CORP; 12.07.1995) offenbart ein Verfahren zum Nachweis
von E6/E7 mRNA Transkripten, welche "Indikatoren oder Prediktoren des Risikos
einer Progression zu einer ernsten Dysplasie oder einem zervikalen
Karzinom" sind (S.
2, Zeilen 23-32). Das Prognoseverfahren basiert "auf die Assoziation zwischen einer transkriptionellen
HPV-Aktivität
und dem Risiko zur Entwicklung einer ernsten zervikalen Dysplasie
oder eines Karzinoms" (S.
2, Zeile 58). Dieses Dokument erklärt, dass "die Expression der E6- und/oder E7-Gene
von HPV 16 und 18 für
die zelluläre
Transformation wichtig sind und für die Entwicklung von CIS wichtig
sein können" (S. 4, Zeile 40)
und dass "die E6*-Transkripte
sich auf ein onkogenes Potential der HPV-Arten beziehen können" (S. 5, Zeile 4).
Ferner wird offenbart, dass spezifische Expressionsmuster "die Basis bereitstellen,
auf der das vorliegende Verfahren verwendet wird, um das Risiko
einer Entwicklung von zervikalen Abnormalitäten zu bestimmen" (S. 5, Zeilen 11-14).
-
EP-A-0
373 352 (BEHRINGWERKE AG; 20.06.1990) offenbart ein Verfahren zum
Nachweis von HPV E6/E7 mRNA (Beispiele 1-4) als Hinweis auf das
maligne Potential des HPV (Seite 2, Zeilen 16-21) und gibt eine
Erklärung über die
Assoziation zwischen HPV und Gebärmutterhalskrebs,
der Bedeutung einer E6/E7-Genomintegration auf eine maligne Transformation
und der intensiven Transkription von E6/E7 in transformierten Zellen
(S. 2). Das Verfahren zielt auf den Nachweis von E6/E7-Transkripten
zum Prognosezweck ab (S. 5, Zeile 7 und Zeile 34). Ferner offenbart
es Primer, um E6/E7 im mRNA zu amplifizieren (Beispiele 4a und 4b).
-
WO
94 26934 A (BROWN JANICE T; BAXTER DIAGNOSTICS INC (US); 24.11-1994)
offenbart einen spezifischen Assay für HPV-Infektionen, die mit
einer zervikalen Dysplasie und einer zellulären Transformation zur Malignität durch
Nachweis von E6/E7 mRNA-Transkripten von Hochrisiko-HPV-Arten assoziiert
sind (S. 2, Zeilen 23-32). Das Dokument erklärt, dass "die Expression von E6/E7 für Gebärmutterhalskrebs
oder prä-maligne
Stadien diagnostisch ist".
-
SMITHS
H L ET AL ('Application
of the NASBA nucleic acid amplification method for the detection
of human Papillomvirus type 16 E6-E7 transcripts' JOURNAL OF VIROLOGICAL METHODS, AMSTERDAM, NL,
Bd. 54, Nr. 1, 1995, Seiten 75-81) beschreibt ein Verfahren zum
Nachweis der Expression von HPV E6-mRNA-Transkripten in zervikalen
Abstrichen durch eine isothermale NASBA-Amplifikation (s. Zusammenfassung
und Seiten 76-80). Darin wird erklärt, dass "eine schnelle HPV-16-RNA-Detektion in
epidemiologischen Studien oder als diagnostisches Werkzeug potentiell
von Wert sein könnte" und dass "die spezifische Detektion
von (E6/E7) RNA den Nachweis von transkriptionell aktiven viralen
Infektionen ermöglichen würde" und dass "die Expression von
E6 und E7 das maligne Stadium zu induzieren und zu erhalten scheint" (Seite 76). Das
Dokument offenbart außerdem
Primerpaare, um HPV16 E6/E7 mRNA zu amplifizieren.
-
Die
Erfinder haben festgestellt, dass es möglich ist, eine klinisch sinnvolle
Bestimmung einer HPV-assoziierten Krankheit lediglich basierend
auf einer einfachen Positiv-/Negativ-Bestimmung der Expression von HPV L1
und E6-mRNA Transkripten durchzuführen, ohne dass genaue quantitative
Messungen der Expressionsspiegel oder Unterschiede der Expressionsspiegel
der beiden Transkripte notwendig sind. Dieses Verfahren ist technisch
einfach und kann in einer bevorzugten Ausführungsform für eine Automatisierung
in einem Format mit mittlerem bis hohem Durchsatz modifiziert werden.
Weiterhin haben die Erfinder auf der Basis der erhaltenen Ergebnisse
ein neuartiges Schema zur Klassifizierung von Patienten auf der
Basis des Risikos einer Entwicklung von Zervixkarzinom entwickelt,
das sich auf krankheitsrelevante molekulare Veränderungen in dem Muster der
HPV-Genexpression bezieht und unabhängig von der CIN-Klassifikation
ist.
-
Dieses
Verfahren umfasst ein in-vitro-Verfahren zur Durchmusterung menschlicher
Versuchspersonen, um deren Risiko zur Entwicklung eines Zervixkarzinoms
zu ermitteln, umfassend die Durchmusterung der Expression von mRNA-Transkripten
aus dem L1-Gen und dem E6-Gen von humanem Papillomvirus, wobei die
Versuchspersonen hinsichtlich der Expression von L1 und/oder der
vollständigen
E6-mRNA gewertet werden, ein Risiko zur Entwicklung eines Zervixkarzinoms
zu haben.
-
Ein
positives Durchmusterungsergebnis in dem Verfahren wird durch eine
positive Expression von L1-mRNA und/oder E6-mRNA in Zellen der Gebärmutter
angezeigt. Eine positive Expression einer dieser mRNAs oder beider
mRNAs wird als Hinweis dafür
genommen, dass die Versuchsperson "einem Risiko" zur Entwicklung eines Zervixkarzinoms
ausgesetzt ist. Frauen, die E6-mRNA exprimieren, unterliegen einem
hohen Risiko, Zellveränderungen
zu entwickeln, da onkogene E6 und E7 an regulatorische Zellzyklusproteine binden
und als Schalter für
die Zellproliferation wirken. Eine klare Expression von E6-mRNA
stellt einen direkten Hinweis von Zellveränderungen in der Gebärmutter
dar. Eine Expression von L1-mRNA
mit oder ohne Expression von E6-mRNA weist ebenfalls auf das Vorliegen
eines aktiven HPV hin.
-
Im
weiteren Kontext einer zervikalen Durchmusterung können Frauen,
die hinsichtlich einer L1 und/oder E6-mRNA-Expression als positiv
identifiziert wurden, für
eine weitere Untersuchung ausgewählt
werden, beispielsweise durch Verwendung von Zytologie. Daher kann
das Verfahren auf einer Stufe ein technisch einfaches Mittel für eine vorherige
Durchmusterung einer Population von Frauen bereitstellen, um HPV-positive
Individuen zu identifizieren, die für eine weitere Untersuchung
ausgewählt
werden können.
-
In
einer spezifischen Ausführungsform
kann das Verfahren verwendet werden, um Individuen in vier unterschiedliche
Risikoklassen zur Entwicklung eines Zervixkarzinoms auf der Basis
einer Positiv-/Negativauszählung
der Expression von L1- und E6-mRNA verwendet werden.
-
In
einem weiteren Aspekt umfasst das Verfahren ein in-vitro-Verfahren
zur Durchmusterung menschlicher Versuchspersonen, um deren Risiko
zur Entwicklung eines Zervixkarzinoms zu bestimmen, umfassend die
Durchmusterung der Versuchsperson auf die Expression von mRNA-Transkripten
des L1-Gens von HPV und mRNA-Transkripte des E6-Gens von HPV, und Einsortieren der Versuchsperson
in eine der vier Risikokategorien zur Entwicklung von Zervixkarzinom
basierend auf der Expression von L1- und/oder E6-mRNA gemäß der folgenden
Klassifizierung:
- Risikokategorie 1: Versuchspersonen, die
hinsichtlich der Expression von L1-mRNA negativ sind, aber hinsichtlich
der Expression von E6-mRNA von wenigstens einem der HPV-Arten 16, 18, 31,
33, 35, 39, 45, 52, 56, 58, 59, 66 oder 68 positiv sind. Solche
Individuen, die hinsichtlich der Expression von E6-mRNA von wenigstens
einer der HPV-Arten 16, 18, 31 oder 33 positiv sind, werden unter
ein höheres
Risiko fallend gewertet als beispielsweise im Vergleich zu Individuen,
die für
diese Arten negativ sind, aber positiv hinsichtlich der Expression
von E6-mRNA von wenigstens einer der HPV-Arten 35, 39, 45, 52, 56,
58, 59, 66 oder 68.
- Risikokategorie 2: Versuchspersonen, die hinsichtlich der Expression
von L1-mRNA und der Expression von E6-mRNA von wenigstens einem
der HPV-Arten 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66 oder
68 positiv sind. Solche Individuen, die hinsichtlich der Expression
von E6-mRNA von wenigstens einer der HPV-Arten 16, 18, 31 oder 33
positiv sind, werden unter ein höheres
Risiko fallend gewertet als beispielsweise im Vergleich zu Individuen,
die für
diese Arten negativ sind, aber positiv hinsichtlich der Expression
von E6-mRNA von wenigstens einer der HPV-Arten 35, 39, 45, 52, 56,
58, 59, 66 oder 68.
- Risikokategorie 3: Individuen, die hinsichtlich der Expression
von L1-mRNA-positiv sind, aber negativ hinsichtlich der Expression
von E6-mRNA von Krebs-assoziierten HPV-Arten (z.B.
- negativ hinsichtlich der Expression von E6-mRNA von HPV-Arten
16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66 und 68).
- Risikokategorie 4: Versuchspersonen, die hinsichtlich der Expression
von L1-mRNA negativ sind und hinsichtlich der Expression von E6-mRNA
negativ sind.
-
In
einer bevorzugten Ausführungsform
ist eine positive Expression durch das Vorliegen von mehr als 50
Kopien des Transkriptes pro ml (oder das Gesamtvolumen der Probe)
gekennzeichnet, und eine negative Expression ist durch das Vorliegen
von weniger als eine Kopie des Transkriptes pro ml (oder Gesamtvolumen der
Probe) gekennzeichnet.
-
Die
oben genannte Klassifizierung basiert auf den molekularen Ereignissen,
die hinsichtlich des Risikos zur Entwicklung eines Zervixkarzinoms
relevant sind, und sind unabhängig
von dem CIN-Status der Versuchspersonen. Daher kann dieses Klassifizierungsverfahren
eine Alternative zur Verwendung der Zytologie in einer Routinedurchmusterung
von Frauen darstellen, um solche Frauen zu identifizieren, die einem
potentiellen Risiko zur Entwicklung von Gebärmutterhalskrebs ausgesetzt
sind. Das Verfahren kann auch als zusätzliche Maßnahme zur Zytologie verwendet
werden, beispielsweise als ein Bestätigungstest, um eine Risikoeinschätzung basierend
auf der Zytologie zu bestätigen.
-
Frauen,
die hinsichtlich der Expression einer Hochrisiko E6-mRNA von einem
der HPV-Arten 16,
18, 31 oder 33 positiv sind, jedoch hinsichtlich der Expression
von L1 negativ sind, befinden sich auf dem höchsten Risikoniveau zur Entwicklung
von schweren Zellveränderungen
und Zellabnormalitäten.
Dies ist auf die Tatsache zurückzuführen, dass
ein Negativergebnis für
eine L1-mRNA-Expression direkt auf einen integrierten HPV hinweist
und daher eine höhere
Wahrscheinlichkeit für
eine starke und konstante Expression von E6 und E7 besteht. Die
Integration eines Virus in das humane Genom hat auch eine direkte
Wirkung auf die Stabilität
der Zellen. Die Integration von HPV reduziert auch die Möglichkeit
einer Regression von Zellveränderungen.
-
Frauen,
die hinsichtlich der Expression von E6-mRNA von einer der HPV-Arten
16, 18, 31 oder 33 positiv sind und hinsichtlich der Expression
von L1-mRNA positiv sind, besitzen eine "Hochrisiko"-HPV-Expression, und es ist immer noch
möglich,
dass sich das HPV integriert hat. Jedoch wird das Risiko dieser
Frauen nicht als so hoch klassifiziert wie bei solchen Frauen, die
L1-negativ und E6-positiv sind, da eine realistische Wahrscheinlichkeit
besteht, dass sie kein integriertes HPV besitzen.
-
Frauen,
die hinsichtlich der Expression von E6-mRNA von den HPV-Arten 16,
18, 31 oder 33 negativ sind, aber hinsichtlich der Expression von
E6-mRNA von anderen HPV-Arten positiv sind, z.B. 35, 39, 45, 52, 56,
58, 59, 66 und 68, werden noch immer "mit Risiko" angesehen und können daher in die Risikokategorien 1
oder 2 (wie oben definiert) eingeordnet werden, was davon abhängt, ob
diese hinsichtlich der Expression von L1-mRNA positiv oder negativ
sind.
-
Frauen,
die hinsichtlich L1-mRNA positiv, aber hinsichtlich E6-mRNA negativ
sind, werden unter ein moderates Risiko fallend gewertet. Es können Hochrisiko-HPV-Arten
in der Probe vorliegen und eine L1-Expression weist auf eine lytische
Aktivität
hin. Es können
auch integrierte HPV-Arten vorkommen, jedoch nur bei Viren, die
selten sind. Jedoch kann ein Nachweis einer lytischen Aktivität zeigen,
dass die Zelle bald anfängt, einige
Veränderungen
durchzumachen.
-
Im
weiteren Kontext einer zervikalen Durchmusterung kann das Verfahren
verwendet werden, um Frauen hinsichtlich ihres Risikos zur Entwicklung
eines Zervixkarzinoms zu klassifizieren, und kann daher eine Basis
für Entscheidungen
darstellen, welche die Behandlung und/oder weitere Durchmusterung
betrifft. Zum Beispiel: Frauen der Risikokategorie 1, insbesondere
solche, die eine positive Expression von E6-mRNA von wenigstens
einem der HPV-Arten 16, 18, 31 oder 33 aufweisen, könnten identifiziert
werden, dass sie eine "Sofortmaßnahme" benötigen, das
heißt
eine Konisation oder Kolposkopie, einschließlich einer Biopsie und Histologie.
-
Frauen
der Risikokategorie 2, wie oben definiert, könnten gewertet werden, dass
sie eine Sofortbehandlung benötigen,
das heißt
eine Kolposkopie allein oder eine Kolposkopie einschließlich einer
Biopsie und Histologie.
-
Frauen
der Risikokategorie 3, wie oben definiert, könnten gewertet werden, dass
sie eine sofortige Wiederholungsuntersuchung benötigen, das heißt eine
Aufforderung zu einem weiteren Test auf eine HPV-Expression unmittelbar
oder nach einem relativ kurzen Zeitraum, z.B. sechs Monate.
-
Frauen
der Risikokategorie 4, wie oben definiert, könnten dem Durchmusterungsprogramm
zurückverwiesen
werden, um auf eine HPV-Expression zu einem späteren Zeitpunkt erneut getestet
zu werden.
-
In
einer weiteren Ausführungsform
stellt das Verfahren ein in-vitro-Verfahren zur Durchmusterung menschlicher
Versuchspersonen auf das Vorliegen von integriertem HPV oder eines
modifizierten episomalen HPV-Genoms bereit, wobei das Verfahren
die Durchmusterung der Versuchsperson auf die Expression von mRNA-Transkripten
von dem L1-Gen und dem E6-Gen
des humanen Papillomvirus umfasst, wobei die Versuchspersonen, die
hinsichtlich der Expression von L1-mRNA negativ, aber hinsichtlich
der Expression von E6-mRNA positiv sind, als Träger von integriertem HPV gewertet
werden.
-
Der
Ausdruck "integriertes
HPV" bezeichnet
ein HPV-Genom, das in das menschliche Genom integriert ist.
-
Der
Ausdruck "modifiziertes
episomales HPV-Genom" wird
verwendet, um ein HPV-Genom
zu bezeichnen, das innerhalb einer Zelle der menschlichen Versuchsperson
als ein Epsiom vorliegt, d.h. nicht in das menschliche Genom integriert
ist, und das eine Modifikation trägt, die äquivalent ist mit dem Wildtyp
HPV-Genom, wobei die Modifikation zu einer konstitutiven oder andauernden
Expression von Transkripten der E6- und/oder E7-Gene führt. Die "Modifikation" wird typischerweise
eine Deletion, Multimerisierung oder Concatermerisierung des Episoms,
eine Neuanordnung des Episoms etc. sein und die Regulation der E6-/E7-Expression
beeinflussen.
-
Wie
zuvor gesagt, wird das Vorliegen von integriertem HPV oder eines
modifizierten episomalen HPV-Genoms durch ein Negativergebnis auf
der L1-mRNA Expression angezeigt, zusammen mit einem Positivergebnis
der Expression von E6-mRNA in Zellen der Zervix. Daher hängt die
Fähigkeit
zur Vorhersage des Vorliegens von integriertem HPV oder eines modifizierten
episomalen HPV-Genoms in diesem Assay in kritischer Weise von der
Fähigkeit
ab, ein Negativergebnis auf L1-mRNA-Expression zu werten. Dies erfordert eine
Nachweistechnik, die eine größtmögliche Empfindlichkeit
besitzt, jedoch so wenig wie möglich
Falsch-Negativ-Ergebnisse erzeugt. In einer bevorzugten Ausführungsform
wird dies unter Einsatz einer sensitiven Amplifikation und einer
Echtzeitdetektionstechnik erreicht, um das Vorliegen oder Fehlen
von L1-mRNA zu durchmustern. Die am meisten bevorzugte Technik ist
eine Echtzeit-NASBA-Amplifikation unter Verwendung molekularer Signalsonden,
wie von Leone et al., Nucleic Acids Research, 1998, Bd. 26, 2150-2155,
beschrieben. Aufgrund der Empfindlichkeit dieser Technik wird das
Vorkommen von Falsch-Negativ-Ergebnissen reduziert und ein Ergebnis
einer "negativen
L1-Expression" kann
mit größerer Sicherheit
gewertet werden.
-
Gemäß der Erfindung
kann ein Verfahren zur Durchmusterung menschlicher Versuchspersonen
auf das Vorliegen von integriertem HPV oder eines modifizierten
episomalen HPV-Genoms auf eine Durchmusterung der Expression von
E6-mRNA allein basieren. Daher betrifft die Erfindung ein in-vitro-Verfahren
zur Durchmusterung humaner Versuchspersonen auf das Vorliegen von
integriertem HPV, wobei das Verfahren die Durchmusterung der Versuchsperson
auf die Expression von mRNA-Transkripten von dem E6-Gen des human
Papillomvirus umfasst, insbesondere von jeder der einzigen HPV-Arten
16, 18, 31, 33 und 45 unter Verwendung eines Amplifikationsverfahrens,
wobei die Versuchspersonen hinsichtlich der Expression von E6-mRNA
von wenigstens einer der genannten HPV-Arten positiv sind und als
Träger
von integriertem HPV gewertet werden.
-
Darüber hinaus
werden Individuen in eine der beiden Risikokategorien zur Entwicklung
von Gebärmutterhalskrebs
basierend auf einer "An-/Aus"-Bestimmung der Expression
von E6-mRNA allein
eingestuft. Daher stellt die Erfindung insbesondere ein in-vitro-Verfahren
zur Durchmusterung humaner Versuchspersonen bereit, um deren Risiko
zur Entwicklung von Gebärmutterhalskrebs
zu bestimmen, wobei das Verfahren die Durchmusterung der Versuchsperson
auf die Expression von mRNA-Transkripten des E6-Gens von jeder der einzigen
HPV-Arten 16, 18, 31, 33 und 45 unter Verwendung eines Amplifikationsverfahrens
und die Einstufung der Versuchsperson in eine der beiden Risikokategorien
zur Entwicklung von Gebärmutterhalskrebs
basierend auf der Expression von E6-mRNA von wenigstens einer der
HPV-Arten umfasst, wobei die Individuen, die hinsichtlich der Expression
der E6-mRNA positiv sind, als Träger
von integriertem HPV gewertet werden und daher als unter "hohes Risiko" fallend zur Entwicklung
von Gebärmutterhalskrebs
klassifiziert werden, wobei Individuen, die hinsichtlich der Expression
der E6-mRNA negativ sind, als kein Träger von integriertem HPV gewertet
werden und deshalb in "kein
nachweisbares Risiko" zur
Entwicklung von Gebärmutterhalskrebs
klassifiziert werden.
-
Im
Kontext der zervikalen Durchmusterungs-Klassifizierung von Versuchspersonen
in die beiden Gruppen mit "hohem
Risiko" oder "keinem nachweisbaren
Risiko" zur Entwicklung
eines Zervixkarzinoms stellt dies eine Basis für Entscheidungen bezüglich der
Behandlung und/oder weiteren Durchmusterung dar. Beispielsweise
können
Versuchspersonen in der Hochrisiko-Kategorie gewertet werden, dass sie
eine sofortige weitere Analyse benötigen, z.B. durch eine histologische
Kolposkopie, während
solche in der nicht nachweisbaren Risikokategorie zurück in das
Durchmusterungsprogramm mit drei oder fünf Jahresintervallen verwiesen werden
können.
Diese Verfahren sind insbesondere zur Bestimmung des Risikos zur
Entwicklung eines Karzinoms in Versuchspersonen verwendbar, bei
denen eine Infektion mit HPV bekannt ist, z.B. solche, die auf HPV-DNA
positiv getestet wurden, oder Versuchspersonen, bei denen zuvor
eine zervikale Abnormalität über eine
Zytologie oder einem Pap-Abstrich festgestellt wurde. Versuchspersonen,
die in die "Nicht-Risiko-Kategorie" auf der Basis der
E6-mRNA-Expression eingeordnet wurden, können HPV-DNA besitzen, jedoch
zeigt das Negativergebnis auf eine E6-Expression, dass HPV zum Testzeitpunkt
nicht mit einer onkogenen Aktivität im Zusammenhang stand.
-
Das
Vorliegen von integriertem HPV, was anhand eines positiven Ergebnisses
auf eine E6-mRNA-Expression angezeigt wird, zeigt schon selbst,
dass die Versuchsperson abnormale Zellveränderungen in der Gebärmutter
besitzt. Daher wird ein Verfahren bereitgestellt, das einem in-vitro-Verfahren
zur Identifizierung menschlicher Versuchspersonen mit abnormalen
Zellveränderungen
in der Gebärmutter
entspricht, wobei das Verfahren der Durchmusterung der Versuchsperson
auf eine Expression von mRNA-Transkripten des E6-Gens von HPV, wie
oben aufgelistet, entspricht, wobei die hinsichtlich einer Expression
von E6-mRNA positiven Individuen mit abnormalen Zellveränderungen
in der Gebärmutter
identifiziert werden.
-
Der
Ausdruck "abnormale
Zellveränderungen
in der Gebärmutter" umfasst Zellveränderungen,
die für eine
schwerere Krankheit charakteristisch sind als niedrig-gradige zervikale
Läsionen
oder geringe intraepitheliale Plattenläsionen, einschließlich Zellveränderungen,
die charakteristisch sind für
eine Krankheit, deren Schwere gleich oder größer ist als hochgradige CIN
(definiert als eine neoplastische Expansion von transformierten
Zellen), CIN (zervikale intraepitheliale Neoplasie) III, oder schwere
intraepitheliale Platten-Neoplasie (HSIL),
einschließlich
Läsionen
mit einem multiploiden DNA-Profil und "maligne" CIN-Läsionen mit
erhöhten DNA-Index-Durchschnittswerten,
einem hohen Prozentsatz einer DNA-Aneuplodie und 2.5c Überschussraten ((Hanselaar
et al., 1992, Anal Cell Pathol., 4:315-324; Rihet et al., 1996,
J. Clin Pathol 49:892-896; and McDermott et al., 1997, Br. J. Obstet
Gynaecol. 104:623-625).
-
Eine
zervikale intraepitheliale Neoplasie (abgekürzt "CIN"),
auch zervikale Dysplasie genannt, stellt einen zervikalen Zustand
dar, der von humanem Papillomvirus verursacht wird. CIN wird als
I, II oder III in Abhängigkeit
von deren Schwere klassifiziert. Sie wird als präkarzinogene Abnormalität angesehen,
stellt jedoch keinen eigentlichen Krebs dar. Die schwächste Form,
CIN I, verschwindet normalerweise von selbst, obwohl sie sich selbst
manchmal zu Krebs entwickeln kann. Die schweren Formen, CIN II und
CIN III, bleiben meistens gleich oder werden mit der Zeit schlimmer.
Sie können
zu einem Krebs entarten, meist jedoch nicht, wenn sie richtig behandelt
wurden.
-
HPV
wurde als auslösendes
Mittel bei der Entwicklung zellulärer Veränderungen in der Gebärmutter identifiziert,
was zur Entwicklung eines Zervixkarzinoms führen kann. Diese zellulären Veränderungen
sind mit einer konstitutiven oder anhaltenden Expression von E6/E7-Proteinen von dem
viralen HPV-Genom assoziiert. Daher ist es möglich, daraus zu schließen, dass
Versuchspersonen, bei denen die Expression von E6-mRNA nachgewiesen
wird, insbesondere solche Versuchspersonen, die eine anhaltende
E6-Expression über
einen längeren
Zeitraum aufweisen, bereits zelluläre Veränderungen in der Gebärmutter
durchgemacht haben. Diese Veränderungen
können
in nur wenigen Zellen der Gebärmutter
stattgefunden haben und können
unter Umständen
durch eine konventionelle Zytologie nicht detektierbar sein. Trotzdem
ist es bei Verwendung der empfindlichen, spezifischen und genauen
Verfahren zum Nachweis von E6-mRNA möglich, solche Versuchspersonen
zu identifizieren, die bereits zelluläre Veränderungen in der Gebärmutter
zu einem viel früheren
Zeitpunkt aufweisen, als es bei Verwendung konventioneller zytologischer
Durchmusterung möglich
wäre. Dies
ermöglicht
einen früheren
Eingriff mit Behandlungen, die darauf ausgelegt sind, die Entwicklung
eines Zervixkarzinoms zu verhindern.
-
Als
Folge der HPV-Integration in das humane Genom oder als Folge der "Modifikation" in modifiziertes episomales
HPV-Genom ist die normale Kontrolle der viralen E6/E7-Onkogen-Transkription verloren
gegangen (Durst et al., 1985, J Gen Virol, 66(Pt 7): 1515-1522;
Pater and Pater, 1985 Virology 145:313-318; Schwarz et al., 1985,
Nature 314: 111-114; Park et al., 1997, ibid). Im Gegensatz dazu
können
in prä-malignen
Läsionen HPV-infizierte
normale Epithel-Papillomviren
in "nicht modifizierten" episomalen Formen
vorherrschen, und somit kann eine onkogene (E6/E7) Transkription
fehlen oder effizient heruntergeregelt sein (Johnson et al., 1990, J
Gen Virol, 71 (PT 7): 1473-1479; Falcinelli et al., 1993, J Med
Virol, 40: 261-265). Es wurde festgestellt, dass die Integration
humaner Papillomvirus-Typ 16-DNA in das humane Genom zu einer unstabileren
Zellaktivität/Genom
und zu einer zunehmenden Stabilität von E6- und E7-mRNA führt (Jeon and Lambert, 1995,
Proc NatI Acad Sci USA 92: 1654-1658). Daher erscheint eine HPV-Integration,
die typischerweise in Gebärmutterhalskrebsen,
nicht jedoch häufig
in CIN-Läsionen
vorgefunden wird (Carmody et al., 1996, Mol Cell Probes, 10: 107-116),
ein wichtiges Ereignis für
die zervikale Karzinogenese darzustellen.
-
Die
vorliegenden Verfahren weisen eine virale E6/E7-mRNA-Expression
in der Gebärmutter
anstelle von DNA nach. Eine virale E6/E7-Expression in Zervixzellen
stellt eine viel genauere Bestimmung des Risikos zur Entwicklung
von Krebs dar, als einfach das Vorliegen des HPV-Virus zu zeigen.
Ferner kann der Nachweis von HPV-Onkogen-Transkripten ein empfindlicher
Indikator der direkten Beteiligung von viralen Onkogenen bei der
Karzinogenese darstellen (Rose et al., 1994, Gynecol Oncol, 52:
212-217, Rose et al., 1995, Gynecol Oncol, 56: 239-244). Der Nachweis
von E6/E7-Transkripten durch eine Amplifikation und Nachweis ist
ein nützliches
diagnostisches Werkzeug für
Risikobewertungen hinsichtlich der Entwicklung von CIN und deren Verlauf
zu Gebärmutterhalskrebs,
insbesondere in Hoch-Risiko-HPV-Typ-infizierten
Patientinnen mit ASCUS und CIN I(Sotlar et al., 1998, Gynecol Oncol,
69: 114-121; Selinka et al., 1998, Lab Invest, 78: 9-18).
-
Die
Expression von E6/E7-Transkripten von HPV-16/18 wird einheitlich
mit dem physikalischen Zustand von HPV-DNA korreliert (Park et al.,
1997, Gynecol Oncol, Bd:65(1), 121-9). In den meisten zervikalen Karzinomzellen
werden die E6- und E7-Gene von spezifischen humanen Papillomviren
von viralen Sequenzen transkribiert, die in Wirtszellchromosomen
integriert sind (von Kleben Doeberitz et al., 1991, Proc NatI Acad Sci
U S A. Bd.:88(4), 1411-5). Die virale Belastung und Integration
wurden im großen
Maßstab
bei CIN-Läsionen
untersucht (Pietsaro et al., 2002, J Clin Microbiol, Bd.:40(3),
886-91). Lediglich eine Probe enthielt ausschließlich episomale HPV16-DNA und
diese Läsion
entwickelte sich spontan zurück.
Siebzehn von 37 invasiven zervikalen Karzinomproben wurden zuvor
identifiziert, dass sie das vollständig integrierte HPV16-Genom enthalten,
indem eine PCR eingesetzt wurde, welche das gesamte E1/E2-Gen abdeckt,
und dies wurde durch rIiPCR in 16 Fällen bestätigt. Ein Fall zeigte jedoch
einen niedrigen Spiegel episomaler Desoxyribonukleinsäure neben
der vorherrschenden integrierten Form. Von den verbleibenden 20
Karzinomproben, die episomale Formen der zuvor genannten Analyse
zeigen, wurde bei 14 unter Verwendung von rIiPCR festgestellt, dass sie
integrierte Formen enthalten, und vier enthielten multimere (modifizierte)
episomale Formen. Daher zeigten insgesamt 31 von 37 der Karzinome
(84 %) integriertes HPV16-Genom, während ein Ausbleiben der Integration
nicht nachgewiesen werden konnte (Kalantari et al., 2001, Diagn
Mol Pathol, Bd:10(1), 46-54).
-
Es
gab so gut wie keine Beobachtungen, dass zervikale Karzinomzellen
ohne integriertem HPV oder modifiziertem episomalem HPV-DNA existieren
(Kalantari et al. 2001; Pietsaro et al., 2002, ibid). Es wurde ferner
gezeigt, dass E6 und E7 nur von integrierter oder modifizierter
episomaler HPV-DNA transkribiert werden kann (von Kleben Doeberitz
et al., 1991, ibid). Daher vermuten die Erfinder, dass der Nachweis
einer E6/E7-Expression einen direkten Hinweis auf integriertes HPV
oder modifiziertes episomales HPV sowie eine hohe Onkogen-Aktivität liefert
und schließen
daraus, dass in einem klinischen Kontext der Nachweis einer E6 (E6/E7)-Expression allein
ausreicht, um Versuchspersonen mit "hohem Risiko" zur Entwicklung eines zervikalen Karzinoms
zu identifizieren. Mit anderen Worten: wenn eine E6/E7-mRNA- Expression in einer
zervikalen Probe nachgewiesen werden kann, so weist dies direkt
auf zelluläre
Abnormalitäten
in der Gebärmutter
hin, und es besteht ein sehr hohes Risiko zur Entwicklung eines
Zervixkarzinoms aufgrund einer andauernden HPV-Onkogen-Aktivität. Daher
weist der Nachweis von E6/E7-mRNA in einer menschlichen Versuchsperson darauf
hin, dass die Versuchsperson einem sehr hohen Risiko zur Entwicklung
eines Zervixkarzinoms ausgesetzt ist und eine sofortige weitere
Durchmusterung durchlaufen sollte, z.B. mittels Kolposkopie.
-
Wenn
eine HPV-E6/E7-mRNA-Expression nicht nachgewiesen wird, kann die
Versuchsperson noch immer eine HPV-Infektion haben. Jedoch kann
sich diese aufgrund einer fehlenden Integration und Onkogen-Aktivität spontan
zurückentwickeln
(wie von Pietsaro et al., 2002, ibid, beobachtet).
-
In
einem klinischen Kontext ist die Leistungsfähigkeit der Verfahren, welche
von der Durchmusterung auf eine Expression von E6-mRNA alleine abzielen,
in kritischer Weise abhängig
von der Fähigkeit,
ein negatives Ergebnis auf eine E6-mRNA-Expression mit Sicherheit
zu werten. Dies erfordert wiederum eine Nachweistechnik, die eine
maximale Empfindlichkeit besitzt, und ferner so wenig wie möglich Falsch-Negativ-Ergebnisse
produziert. In einer bevorzugten Ausführungsform wird dies unter
Verwendung einer empfindlichen Amplifikation und einem Echtzeit-Nachweisverfahren
erreicht, um auf das Vorliegen oder Fehlen von E6-mRNA zu durchmustern.
Die bevorzugte Technik ist eine Echtzeit-NASBA-Amplifikation unter Verwendung von molekularen
Signalsonden, wie von Leone et al, Nucleic Acids Research, 1998,
Bd. 26, 2150-2155, beschrieben. Aufgrund der Sensitivität dieser
Technik ist das Auftreten von Falsch-Negativ-Ergebnissen minimiert,
und es kann das Ergebnis einer "negativen
E6-Expression" mit
größerer Sicherheit
gewertet werden. Dies ist extrem wichtig, wenn die Assays im Zusammenhang
eines klinischen Durchmusterungsprogramms verwendet werden.
-
In
den erfindungsgemäßen Verfahren,
die auf dem Nachweis von E6-mRNA allein basieren, ist es notwendig,
dass nur HPV 16, 18, 31, 33 und 45 nachgewiesen wird. DNA von den
HPV-Arten 16, 18, 31 und 33 wurde in mehr als 87 % der zervikalen
Karzinomproben nachgewiesen (Karlsen et al., 1996, J Clin Microbiol, 34:2095-2100).
Andere Untersuchungen haben gezeigt, dass E6 und E7 beinahe ausnahmslos
in zervikalen Krebsen vorkommen, da deren Expression vermutlich
zur Umwandlung und Erhaltung des malignen Zustandes notwendig ist
(Choo et al., 1987, J Med Virol 21:101-107; Durst et al., 1995,
Cancer Genet Cytogenet, 85: 105-112). Im Gegensatz zu HPV-Nachweissystemen,
die auf dem Nachweis des nicht beschädigten Genoms oder der L1-Gensequenz
basieren, kann der Nachweis von HPV-mRNA, die von der E6/E7-Gegend exprimiert wird,
mehr als 90 % der Patientinnen nachweisen, die direkt mit einem
Risiko zur Entwicklung eines Zervixkarzinoms in Beziehung gebracht
werden.
-
In
der Klinik werden Verfahren basierend auf dem Nachweis von E6-mRNA
zur Verwendung für
ein Post-Screening bevorzugt, d.h. für eine weitere Analyse der
Individuen mit einer zuvor erstellten Diagnose von ASCUS, CIN 1
oder Kondylom. Das Verfahren kann verwendet werden, um solche mit
einem hohen Risiko zur Entwicklung eines Zervixkarzinoms von einer
Gruppe von Individuen mit einer zuvor gestellten Diagnose von ASCUS,
CIN 1 oder Kondylom auszuwählen.
ASCUS, Kondylom und CIN I können
mehr oder weniger durch dieselbe Diagnose definiert werden aufgrund
der sehr niedrigen Reproduzierbarkeit zwischen unterschiedlichen
Zytologen und unterschiedlichen zytologischen Abteilungen. Östör (Int J.
Gyn Path. 12:186-192. 1993) fanden, dass lediglich etwa 1 % der
CIN-Fälle
sich zu einem Zervixkarzinom entwickeln können. Daher besteht ein tatsächlicher
Bedarf an einem effizienten Verfahren zur Identifizierung einer
Untergruppe von Individuen mit ASCUS, Kondylom oder CIN I, bei denen
ein substantielles Risiko zur Entwicklung eines Zervixkarzinoms besteht.
Eine der HPV-Arten 16, 18, 31 oder 33 wurde in 87 % der Zervixkarzinom-Fallstudien
von Karlsen et al., 1996, nachgewiesen. Durch den Einschluss von
HPV 45 wurden beinahe 90 % der zervikalen Karzinomproben mit diesen
fünf HPV-Arten
in Beziehung gebracht. Daher werden, basierend auf der Berechnung
aus den von Östör bereitgestellten
Daten (Int J. Gyn Path. 12:186-192, 1993) mehr als 99,9 % der Fälle mit
ASCUS, CIN I oder Kondylom detektierten Fälle von unserem HPV-Nachweis-Kit
nicht erfasst.
-
In
den erfindungsgemäßen Verfahren
wird eine "positive
Expression" einer
mRNA benutzt, um eine Expression oberhalb des Hintergrundes zu bezeichnen.
Es gibt kein absolutes Erfordernis für eine genaue quantitative
Bestimmung des mRNA-Expressionsspiegels oder für eine genaue Bestimmung der
relativen Expressionsspiegel von L1- und E6-mRNA.
-
In
bestimmten Ausführungsformen
können
die erfindungsgemäßen Verfahren
eine quantitative Bestimmung von mRNA-Expressionsspiegeln umfassen.
In einer bevorzugten Ausführungsform
kann eine Bestimmung einer "positiven
Expression" das
Vorliegen von mehr als 50 Kopien der relevanten mRNA (pro ml Probe
oder pro Gesamtvolumen der Probe) erfordern, um eine klare Unterscheidung
zwischen "positiver
Expression" und "negativer Expression" zu machen, wohingegen
eine Bestimmung einer "negativen
Expression" das Vorliegen
von weniger als eine Kopie der relevanten mRNA (pro ml Probe oder
pro GesamtBd.umen der Probe) erfordert.
-
Die
erfindungsgemäßen Verfahren
beinhalten die Durchmusterung auf E6-mRNA unter Verwendung eines
Verfahrens, das in der Lage ist, E6-mRNA von krebsassoziierten HPV-Arten
spezifisch nachzuweisen, vorzugsweise von "Hochrisiko"-krebsassoziierten HPV-Arten. Die Verfahren
beinhalten die Durchmusterung auf E6-mRNA unter Verwendung eines
Verfahrens, das in der Lage ist, E6-mRNA von HPV-Arten 16, 18, 31, 33
und 45 nachzuweisen. Das Verfahren wird die Expression von E6-mRNA
von allen fünf
Arten spezifisch nachweisen. Jedoch können Frauen, die hinsichtlich
einer Expression von E6 von anderen Arten als 16, 18, 31, 33 und
45, z.B. 35, 39, 45, 52, 56, 58, 59, 66 und 68, noch immer "unter Risiko" zur Entwicklung
eines Zervixkarzinoms stehen. Eine Durchmusterung auf die Expression
von E6-mRNA von
einer oder mehreren dieser HPV-Arten, vorzugsweise neben einer Durchmusterung
auf E6-mRNA von den HPV-Arten 16, 18, 31, 33 und 45, kann durchgeführt werden.
Bestimmte HPV-Arten zeigen eine markierte geographische/Populations-Verteilung.
-
Um
Unklarheiten zu vermeiden, umfasst der Ausdruck "E6-mRNA", wie hier verwendet, sämtliche
natürlich
vorkommende mRNA-Transkripte, die das gesamte oder einen Teil des
offenen Leserasters von E6 enthalten, einschließlich natürlich vorkommender Spleiß-Varianten,
und schließt
daher Transkripte ein, die zusätzlich
das gesamte oder einen Teil des offenen Leserahmens von E7 (und
tatsächlich
weitere offene Leserahmen) enthalten, soweit nicht anders angegeben.
Die Ausdrücke
E6/E7-mRNA", "E6/E7-Transkripte" etc. werden austauschbar
mit den Ausdrücken "E6-mRNA", "E6-Transkripte" verwendet und umfassen
auch natürlich vorkommende
mRNA-Transkripte, die den gesamten oder einen Teil des offenen Leserahmens
von E6 enthalten, einschließlich
natürlich
vorkommender Spleiß-Varianten,
und Transkripte, die den gesamten oder einen Teil des offenen Leserahmens
von E7 enthalten. Der Ausdruck "Onkogen-Expression" bezeichnet auch
natürlich
vorkommende mRNA-Transkripte, die den gesamten oder einen Teil des
Leserahmens von E6 enthalten, einschließlich natürlich vorkommender Spleiß-Varianten,
die den gesamten oder einen Teil des offenen Leserahmens von E7
enthalten, soweit nicht anders angegeben.
-
Es
wurden so weit vier E6/E7-mRNA-Spezies in Zellen beschrieben, die
mit HPV 16 infiziert waren, nämlich
ein nicht gespleißtes
E6-Transkript und drei gespleißte
Transkripte, die mit E6*I, E6*II und E6*III bezeichnet sind (Smotkin
D, et al., J Virol. 1989 Mar 63(3):1441-7; Smotkin D, Wettstein
FO. Proc NatI Acad Sci USA. 1986 Jul 83(13):4680-4; Doorbar J. et
al., Virology. 1990 Sep 178(1):254-62; Cornelissen MT, et al. J
Gen Virol. 1990 May 71(Pt 5):1243- 6; Johnson MA, et al. J Gen Virol. 1990
Jul 71(Pt 7):1473-9; Schneider-Maunoun S, et al. J Virol. 1987 Oct
61(10):3295-8; Sherman L, et al. Int J Cancer. 1992 Feb 50(3):356-64).
Alle vier Transkripte werden von einem einzelnen Promotor (p97)
transkribiert, der unmittelbar stromaufwärts des zweiten ATG von dem
E6-ORF lokalisiert ist.
-
In
einer Ausführungsform
können
die Verfahren die Durchmusterung auf E6-Transkripte umfassen, welche
den gesamten oder einen Teil des offenen Leserahmens von E7 enthalten.
Dies kann beispielsweise unter Verwendung von Primern oder Sonden
durchgeführt
werden, die für
die kodierende Region von E7 spezifisch sind.
-
In
einer weiteren Ausführungsform
können
die Verfahren die Durchmusterung auf das Vorliegen von E6-Transkripten "mit voller Länge" umfassen. Im Falle
von HPV 16 bezeichnet der Ausdruck "E6-Transkripte mit voller Länge" Transkripte, die
die gesamte Region von dem Nukleotid (nt) 97 bis nt 880 im den E6-ORF enthalten,
einschließlich
97 und 880. Die Nukleotidpositionen sind entsprechend der Standard-HPV-Nomenklatur
nummeriert (s. Human Papillomvirus Compendium Online, verfügbar über das
Internet oder in Papierform von der HV-Datenbank, Mail Stop K710, Los Alamos
National Laboratory, Los Alamos, NM 87545, USA). Der spezifische
Nachweis von Transkripten mit voller Länge kann beispielsweise unter
Verwendung von Primern oder Sonden durchgeführt werden, die für die Region
spezifisch sind, welche nur in den E6-Transkripten mit voller Länge vorhanden
ist, nicht jedoch in Spleißvarianten.
Unterschiedliche HPV-Arten zeigen unterschiedliche Muster einer
E6/E7-mRNA-Expression.
Die Transkriptkarten für
verschiedene HPV-Arten, einschließlich der HPV-Arten 16 und 31,
welche als Hilfe für
die Konstruktion der Sonden oder Primer zum Nachweis von E6/E7-Transkripten
verwendet werden können,
sind über
das Humane Papillomvirus Compendium (s. oben) öffentlich zugänglich.
-
Es
werden hier E6-Oligonukleotid-Primer beschrieben, die zur Amplifikation
von Regionen der E6-mRNA von verschiedenen HPV-Arten durch NASBA
oder PCR geeignet sind.
-
Verfahren,
welche die Durchmusterung auf eine L1-mRNA-Expression beinhalten,
können
die Durchmusterung auf eine L1-mRNA-Expression unter Verwendung
einer Technik umfassen, die in der Lage ist, L1-mRNA von nahezu
allen bekannten HPV-Arten oder wenigstens von den Haupt-Krebs-assoziierten
Arten nachzuweisen (z.B. vorzugsweise alle HPV-Arten 16, 18, 31
und 33). L1-Primer und Sonden sind hier beschrieben, die in der
Lage sind, L1-mRNA von den HPV-Arten 6, 11, 16, 18, 31, 33, 35 und
51 in Zervixproben nachzuweisen.
-
Man
kann sagen, dass der Nachweis von L1-Transkripten eine HPV-"Virulenz" feststellt, d.h.
das Vorliegen einer lytischen HPV-Aktivität. Es kann gesagt werden, dass
der Nachweis von E6/E7-Transkripten eine HPV-"Pathogenese" feststellt, da eine Expression dieser
mRNAs auf molekulare Ereignisse hinweist, die mit dem Risiko zur
Entwicklung eines Karzinoms assoziiert sind.
-
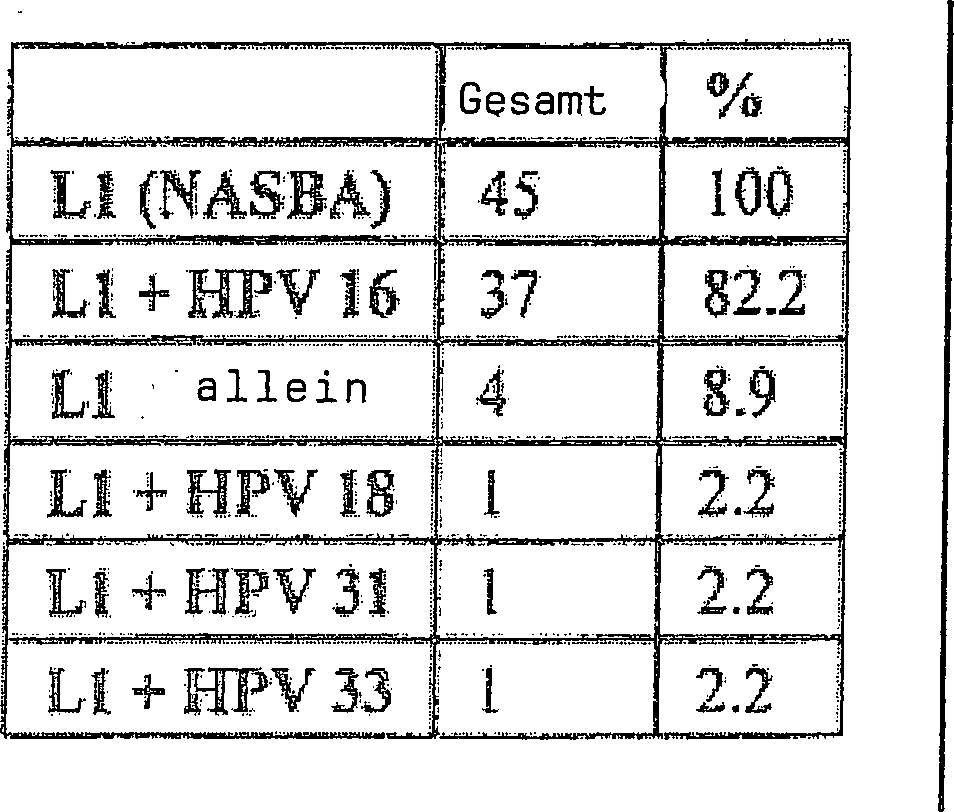
In
einer Studie von 4589 Frauen war es möglich, alle Fälle bis
auf einen von CIN III-Läsionen oder Krebs
unter Verwendung eines Verfahrens nachzuweisen, das auf die Durchmusterung
auf eine Expression von E6- und L1-mRNA basiert (s. nachfolgende
Beispiele).
-
Die
zuvor genannten Verfahren können
die Durchmusterung auf eine Expression von mRNA-Transkripten von
dem humanen p16ink4a-Gen, neben einer Durchmusterung
auf eine Expression von HPV L1- und/oder E6-Transkripten umfassen.
-
Ein
positives Ergebnis auf eine Expression von p16ink4a-mRNA
wird als weiterer Hinweis für
ein Risiko zur Entwicklung eines Zervixkarzinoms herangezogen.
-
p16ink4a, und damit verwandte Familienmitglieder,
kann eine funktionsgemäße Regulation
der Phosphorilierung und der suppressiven Wachstumsaktivität des Restinoblastom-Genprodukts (RB)
besitzen. Dafür spricht,
dass festgestellt wurde, dass es eine umgekehrte Beziehung zwischen
der Expression des p16ink4a-Proteins und
dem Vorliegen normaler RB in ausgewählten Krebszelllinien gibt;
das p16ink4a-Protein ist nachweisbar, wenn
RB mutiert, deletiert oder inaktiviert ist, und es ist in Zelllinien
beträchtlich
vermindert oder fehlt, die ein normales RB enthalten. Kheif et al.
(Kheif SN et al., Proc. NatI. Acad. Sci. USA 93:4350-4354, 1996)
haben festgestellt, dass das p16ink4a-Protein
in humanen zervikalen Karzinomzellen exprimiert wird, die entweder
ein mutantes RB oder ein Wildtyp-RB enthalten, das durch E7 funktionell
inaktiviert ist. Sie zeigen auch, dass die Inaktivierung von RB
mit einer Hochregulation von p16ink4a korreliert,
was einen Rückkopplungsmechanismus
bestätigt,
bei dem p16ink4a und RB beteiligt sind.
Milde-Langosch et al. (Milde-Langosch K, et al., (2001) Virchows
Arch 439: 55-61) haben festgestellt, dass es signifikante Korrelationen
zwischen einer starken p16-Expression und einer HPV 16/18-Infektion
und zwischen einer starken p16-Expression
und einer HPV 16/18 E6/E7-Onkogen-Expression gab. Klaes et al.,
(Klaes R, et al., (2001) Int J Cancer 92: 276-284) beobachteten
eine starke Überexpression
des p16ink4a-Genprodukts in 150 von 152 hochgradigen
dysplastischen zervikalen Läsionen
(CIN II bis invasiver Krebs), während
normale zervikale Epithel- oder inflammatorische oder metaplastische
Läsionen
nicht mit dem monoklonalen p16ink4a-spezifischen
Antikörper
E6H4 gefärbt
wurden. Alle CIN I-gewerteten Läsionen,
die mit HR-HPV-Arten assoziiert waren, zeigten keine oder nur eine
begrenzte oder sporadische Reaktivität, während alle bis auf zwei CIN
I-gewerteten Läsionen,
die mit HR-HPV-Arten assoziiert waren, eine starke und diffuse Färbung auf
p16ink4a zeigten.
-
Die
offenbarten Durchmusterungsverfahren können mit einer Nukleinsäure-Präparation
durchgeführt werden,
die von einer klinischen Probe oder Biopsie isoliert wurde, die
zervikale Zellen enthalten, die von der unter dem Test stehenden
Versuchsperson entnommen wurde. Geeignete Proben, die als Nukleinsäurequelle verwendet
werden können,
umfassen (aber nicht ausschließlich)
zervikale Abstrichstäbchen,
zervikale Biopsien, zervikale Abschabungen, Hautbiopsien/Warzen,
auch paraffineingebettete Gewebe, und mit Formalin oder Methanol
fixierte Zellen.
-
Die
unter Verwendung des offenbarten Verfahrens zur durchmusternde Nukleinsäure-Präparation muss
mRNA einschließen,
es muss sich jedoch nicht um eine Präparation von aufgereinigter
poly A+ mRNA und Präparationen
von Gesamt-RNA oder Rohpräparationen
von Gesamtnukleinsäure,
die sowohl RNA als auch genomische DNA enthalten, oder sogar Rohzelllysate,
die auch als Ausgangsmaterial für
eine NASBA-Reaktion geeignet sind, handeln. Es kann im Wesentlichen
jedes auf dem Gebiet bekannte Verfahren zur Isolierung einer Nukleinsäurepräparation,
die mRNA einschließt,
verwendet werden, um Nukleinsäure
von einer Testprobe zu isolieren. Ein bevorzugtes Verfahren ist
das "Boom"-Isolierungsverfahren,
das in US-A-5,234,809 und EP-B-0389,063 beschrieben ist. Dieses
Verfahren, das zur Isolierung einer Nukleinsäurepräparation, die sowohl RNA als
auch DNA enthält,
verwendet werden kann, basiert auf den Nukleinsäure-Bindungseigenschaften von
Silikondioxidpartikeln beim Vorliegen des chaotrophen Agenzes Guanidin-Thiocyanat
(GuSCN).
-
Die
erfindungsgemäßen Verfahren
basieren auf der Bestimmung der aktiven Transkription des HPV-Genoms
in zervikalen Zellen. Die Verfahren sind nicht bezüglich der
zum Nachweis der mRNA-Expression verwendeten genauen Amplifikationstechnik
beschränkt.
Es sind viele Verfahren zum Nachweis spezifischer mRNA-Sequenzen
im Stand der Technik bekannt und können gemäß der Erfindung verwendet werden.
-
Eine
mRNA-Expression wird mittels eines Amplifikationsverfahrens nachgewiesen,
vorzugsweise durch eine isothermale Amplifikation wie z.B. NASBA,
Transkriptions-vermittelte Amplifikation, Signal-vermittelte Amplifikation
von RNA-Technologie, isothermale Lösungsphasenamplifikation etc.
Alle diese Verfahren sind auf dem Gebiet bekannt. Vorzugsweise wird
eine mRNA-Expression durch eine isothermale Amplifikation zusammen
mit einer Echtzeit-Detektion des Amplifikationsproduktes nachgewiesen.
Die am meisten bevorzugte Kombination ist eine Amplifikation durch
NASBA, gekoppelt mit einer Echtzeitdetektion des Amplifikationsproduktes
unter Verwendung der molekularen Signaltechnologie, wie von Leone
et al., Nucleic Acids Research, 1998, Bd. 26, 2150-2155, beschrieben.
-
Die
Verfahren zum Nachweis von HPV in einer Testprobe unter Verwendung
der NASBA-Technik
werden im Allgemeinen die folgenden Schritte umfassen:
- (a) Zusammenfügen
eines Reaktionsmediums, umfassend geeignete Primer-Paare, eine RNA-gesteuerte DNA-Polymerase,
eine Ribonuklease, welche den RNA-Strang eines RNA-DNA-Hybrids hydrolysiert,
ohne einzelne oder doppelstränige
RNA oder DNA zu hydrolysieren, eine RNA-Polymerase, die diesen Promotor erkennt,
und Ribonukleosid- und Desoxyribonukleosid-Triphosphate;
- (b) Inkubieren des Reaktionsmediums mit einer Nukleinsäurepräparation,
die von einer Testprobe isoliert wurde, die unter Verdacht steht,
HPV zu enthalten, unter Reaktionsbedingungen, die eine NASBA-Amplifikationsreaktion
ermöglichen;
und
- (c) Nachweisen und/oder quantitatives Messen eines HPV-spezifischen
Produktes der NASBA-Amplifikationsreaktion.
-
Der
Nachweis des spezifischen Produktes (der Produkte) der NASBA-Reaktion
(d.h. Sinn- und/oder Antisinn-Kopien
der Ziel-RNA) kann auf vielfältige
Weise durchgeführt
werden. In einem Ansatz kann das NASBA-Produkte) durch Verwendung
einer HPV-spezifischen Hybridisierungssonde nachgewiesen werden,
die in der Lage ist, sich spezifisch an das NASBA-Produkt anzulagern.
Die Hybridisierungssonde kann an einen sichtbaren Marker geknüpft sein,
z.B. eine fluoreszierende, lumineszierende, radioaktive oder chemilumineszierende
Verbindung oder eine Enzymmarkierung oder eine andere Markierungsart,
die für
den Fachmann bekannt ist. Die Art der Markierung ist nicht kritisch,
jedoch sollte sie in der Lage sind, ein Signal zu erzeugen, das
durch externe Mittel nachweisbar ist, entweder selbst oder zusammen
mit einer oder mehreren zusätzlichen
Substanzen (z.B. das Substrat für
ein Enzym).
-
Ein
bevorzugtes Nachweisverfahren ist der sogenannte "Echtzeit-NASBA", der eine kontinuierliche Beobachtung
der Bildung des Produktes der NASBA-Reaktion über den Reaktionsverlauf ermöglicht.
Bei einer bevorzugten Ausführungsform
kann dies mittels einer "molekularen
Signal"-Sonde erreicht
werden, die eine HPV-spezifische Sequenz umfasst, die in der Lage
ist, sich an das NASBA-Produkt anzulagern, eine Stamm-Duplex bildende
Oligonukleotid-Sequenz und ein Paar Fluoreszenz-/Lösch-Reste
anzulagern, wie auf dem Gebiet bekannt und hier beschrieben. Wenn
die molekulare Signalsonde vor der Amplifikation dem Reaktionsgemisch
zugegeben wird, kann es möglich
sein, die Bildung des NASBA-Produktes
in Echtzeit zu verfolgen (Leone et al., Nucleic Acis Research, 1998,
Bd. 26, 2150-2155).
Reagenzien und Apparate zur Durchführung einer Echtzeit-NASBA-Detektion
sind kommerziell erhältlich
(z.B. NucliSensTM EasyQ-System, von Organon
Teknika).
-
In
einem weiteren Ansatz kann die molekulare Signaltechnologie in dem
Primer 2 Oligonukleotid eingebaut werden, was eine Echtzeitverfolgung
der NASBA-Reaktion ermöglicht,
ohne dass eine separate Hybridisierungssonde erforderlich ist.
-
In
einem weiteren Ansatz können
die Produkte der NASBA-Reaktion unter Verwendung einer generischen
markierten Detektionssonde verfolgt werden, die an eine Nukleotidsequenz
in dem 5'-Terminus
des Primer 2 Oligonukleotids hybridisiert. Dies ist äquivalent
zu dem "NucliSensTM"-Detektionssystem,
bereitgestellt von Organon Teknika. In diesem System kann die Spezifität für NASBA-Produkte,
die von der Ziel-HPV-mRNA abgeleitet sind, verliehen werden, indem
HPV-spezifische Abfangsonden verwendet werden, die die hier beschriebenen
Sonden-Oligonukleotide umfassen und an einem Festträger wie
z.B. einem magnetischen Microbead gebunden sind. Vorzugsweise ist
die generische markierte Detektionssonde die ECLTM-Detektionssonde, die
von Organon Teknika bereitgestellt wird. NASBA-Amplikons sind an
die HPV-spezifischen Abfangsonden und die generische ECL-Sonde (über eine
Komplementärsequenz
auf Primer 2) hybridisiert. Nach der Hybridisierung können die
Bead/Amplikon/ECL-Sonden-Komplexe an der magnetischen Elektrode
eines automatischen ECL-Lesegerätes
abgefangen werden (z.B. dem NucliSensTM-Lesegerät, bereitgestellt
von Organon Teknika). Danach steuert ein Spannungspuls die ECLTM-Reaktion.
-
Der
Nachweis von HPV-mRNA ist auch in anderen Krebsarten als Zervixkarzinom
von klinischer Relevanz, einschließlich z.B. Kopf- und Nackenkarzinom,
Mund- und Zungenkarzinom, Hautkarzinom, anales und vaginales Karzinom.
Der Nachweis von HPV-mRNA
kann auch zur Diagnose von Mikrometastasen in Lymphknoten im unteren
Bereich des Körpers
eingesetzt werden.
-
Kits
zur Verwendung zum Nachweis von Transkripten der L1- und E6-Gene
von HPV umfassen wenigstens ein Primer-Paar, das zur Amplifikation
einer Region von L1-Transkripten von wenigstens einer der HPV-Arten
16, 18, 31 und 33 und vorzugsweise auch HPV 45 verwendet werden
kann, sowie einem oder mehreren Primerpaaren, welche eine Amplifikation
einer Region von E6-Transkripten der HPV-Arten 16, 18, 31 und 33
und vorzugsweise auch HPV 45 ermöglicht.
-
Der
Ausdruck "Primer-Paar" wird benutzt, um
ein Paar von Primern zu beschreiben, die in Kombination verwendet
werden, um eine spezifische Region der L1- oder E6-mRNA unter Verwendung
bekannter Nukleinsäuretechniken
zu amplifizieren. In bevorzugten Ausführungsformen werden die in
dem Kit enthaltenen Primer-Paare für eine NASBA-Amplifikation oder ähnliche
isothermale Amplifikationstechniken geeignet sein.
-
Die
einzelnen Primer, aus denen jedes Primer-Paar besteht, das in dem
Kit enthalten ist, können
separat bereitgestellt werden (z.B. als ein separater Behälter von
jedem Primer), oder können
vorzugsweise gemischt in einem einzelnen Behälter bereitgestellt werden.
Kombinationen von zwei oder mehreren Primer-Paaren können in
einem Fertiggemisch in einem einzelnen Behälter innerhalb des Kits bereitgestellt
werden. Es kann geeignet sein, zwei oder mehrere Primer-Paare in
einem einzelnen Behälter
bereitzustellen, wo die beiden oder mehrere Amplifikationsreaktionen "gebündelt", d.h. gleichzeitig
in einem einzelnen Reaktionsgefäß durchgeführt werden.
-
Das/die
Primen-Paar(e), das/die zur Verwendung zur Amplifikation einer Region
von E6-Transkripten geeignet
ist/sind, sollte(n) eine Amplifikation einer Region von E6-mRNA
von den Haupt-Krebs-assoziierten HPV-Arten 16, 18, 31, 33 und auch
HPV 45 ermöglichen.
Es gibt verschiedene Möglichkeiten,
wie dies erreicht werden kann.
-
Der
Kit kann getrennte Primer-Paare enthalten, die spezifisch für jede der
HPV-Arten 16, 18, 31 und 33, und 45 sind. Diese Primer-Paare können in
dem Kit in getrennten Behältern
bereitgestellt werden oder können
als Gemische der beiden oder mehreren Primer-Paaren in einem einzelnen
Behälter
bereitgestellt werden, z.B. um eine Bündelung der Amplifikationsreaktionen
zu ermöglichen.
-
Der
Kit kann ein einzelnes Primer-Paar enthalten, das zur Amplifikation
einer Region des E6-Gens von den HPV-Arten 16, 18, 31, 33, und auch
HPV 45 fähig
ist und somit eine Amplifikation von allen fünf Arten in einer einzelnen
Amplifikationsreaktion ermöglicht.
Dies könnte
beispielsweise durch Verwendung eines Paares degenerierter Primer
erreicht werden oder durch Selektion einer Region der E6-mRNA, die
unter den HPV-Arten hoch konserviert ist.
-
Das
E6-Primer-Paar kann einer beliebigen Region der E6-mRNA entsprechen
und kann eine Amplifikation des gesamten oder eines Teils des offenen
Leserahmens von E6 und/oder des offenen Leserahmens von E7 ermöglichen.
-
Das/die
Primen-Paar(e), das/die zur Verwendung zur Amplifikation einer Region
von N1-Transkripten geeignet
ist (sind), sollte(n) in der Lage sein, eine Region der L1-mRNA
von wenigstens den Hauptkrebs-assoziierten HPV-Arten 16, 18, 31,
33 und vorzugsweise auch HPV 45 zu amplifizieren und wird/werden
vorzugsweise für
die Verwendung zur Amplifikation einer Region von L1-mRNAs von im
Wesentlichen allen bekannten HPV-Arten geeignet sein. Bei Verwendung
solcher Primer ist es möglich,
eine aktive Transkription von L1-mRNAs von mehreren HPV-Arten in
einer einzelnen Amplifikationsreaktion zu testen.
-
Es
ist möglich,
Primer zu konstruieren, die zum Nachweis von L1-Transkripten von
mehreren HPV-Arten durch Auswahl von Regionen des L1-Transkriptes,
die hoch konserviert sind, fähig
sind.
-
In
einem weiteren Ansatz kann die Spezifität für mehrere HPV-Arten erreicht
werden, indem degenerierte Oligonukleotid-Primer oder Komplex-Gemische
von Polynukleotiden verwendet werden, welche nur geringe Sequenzvariationen
aufweisen, vorzugsweise solche, die den Stellen entsprechen, welche
eine Sequenzvariation zwischen HPV-Genotypen aufweisen. Der Grund
hinter der Verwendung solcher degenerierten Primer oder Gemische
ist, dass das Gemisch wenigstens ein Primer-Paar enthalten kann,
das zum Nachweis jeder HPV-Art
fähig ist.
-
In
einem weiteren Ansatz kann die Spezifität für mehrere HPV-Arten erreicht
werden, indem in die Primer ein oder mehrere Inosin-Nukleotide eingebaut
werden, vorzugsweise an Stellen einer Sequenzvariation zwischen
HPV-Genotypen.
-
Die
E6- und L1-Primer-Paare können
in getrennten Behältern
innerhalb des Kits bereitgestellt werden, oder das/die L1-Primer-Paar(e)
kann(können)
als ein Gemisch mit einem oder mehreren E6-Primer-Paaren in einem
einzelnen Behälter
bereitgestellt werden.
-
Die
Kits können
ferner eine oder mehrere Sonden umfassen, die für die Verwendung zur Detektion
der Produkte der Amplifikationsreaktionen, die unter Verwendung
der in dem Kit enthaltenen Primer-Paare durchgeführt wurden, geeignet sind.
Die Sonde(n) kann(können)
als getrenntes Reagenz in dem Kit bereitgestellt werden. Alternativ
kann(können)
die Sonde(n) als ein Gemisch einer oder mehrere Primer-Paare bereitgestellt werden.
-
Die
in dem Kit enthaltenen Primer und Sonden sind vorzugsweise einzelsträngige DNA-Moleküle. Nicht
natürliche,
snythetische Polynukleotide, welche die Fähigkeit besitzen, eine Basenpaarung
mit einem komplementären
Nukleinsäuremolekül einzugehen,
können
ebenfalls verwendet werden, einschließlich synthetischer Oligonukleotide,
welche modifizierte Basen einbauen, und synthetische Oligonukleotide,
bei denen die Verbindungen zwischen einzelnen Nukleosiden andere
Bindungen als Phosphodiester-Bindungen einschließen. Die Primer und Sonden
können
entsprechend bekannter Verfahren auf dem Gebiet hergestellt werden,
wie z.B. durch chemische Synthese unter Verwendung von Standardvorrichtungen
und -protokollen zur Oligonukleotidsynthese.
-
Die
Primer und Sonden werden typischerweise als einzelsträngige Polynukleotide
von nicht mehr als 100 Basenlänge,
typischerweise weniger als 55 Basenlänge, isoliert. Um Unklarheiten
zu vermeiden, ist hier festgelegt, dass die Ausdrücke "Primer" und "Sonde" natürlich vorkommende
HPV-Genome voller Länge
ausschließen.
-
Es
können
mehrere verschiedene Arten von Oligonukleotid-Primern und Sonden,
welche die HPV-spezifischen Sequenzen eingebaut haben, in dem Kit
enthalten sein. Typischerweise werden solche Primer und Sonden zusätzliche
Nicht-HPV-Sequenzen umfassen, beispielsweise Sequenzen, die für eine Amplifikationsreaktion
erforderlich sind oder welche den Nachweis der Produkte der Amplifikationsreaktion
ermöglichen.
-
Die
erste Art von Primern sind Primer 1 Oligonukleotide (hier auch als
NASBA P1 Primer bezeichnet), welche Nukleotide mit einer Länge von
allgemein ungefähr
50 Basen sind, die im Durchschnitt ungefähr 20 Basen am 3'-Ende enthalten,
das komplementär
ist zu einer Region der Ziel-mRNA. Oligonukleotide, die zur Verwendung
als NASBA P1 Primer geeignet sind, werden als "P1/PCR" in Tabelle 1 bezeichnet. P1-Primer- Oligonukleotide
haben die allgemeine Struktur X1-SEQ, wobei
SEQ eine HPV-spezifische Sequenz darstellt und X1 eine
Sequenz ist, die einen Promotor umfasst, der durch eine spezifische
RNA-Polymerase erkannt wird. Bakteriophagen-Promotoren, z.B. die
T7-, T3- und SP6-Promotoren sind zur Verwendung bei den erfindungsgemäßen Oligonukleotiden
bevorzugt, da sie den Vorteil einer Transkription auf hohem Niveau
besitzen, was lediglich von der Bindung der geeigneten RNA-Polymerase
abhängt.
In einer bevorzugten Ausführungsform
kann die Sequenz " X1" die
Sequenz AATTCTAATACGACTCACTATAGGG oder die Sequenz AATTCTAATACGACTCACTATAGGGAGAAGG
umfassen. Diese Sequenzen enthalten einen T7-Promotor, einschließlich der
Transkriptions-Initiations-Stelle für die T7-RNA-Polymerase.
-
Die
HPV-spezifischen Sequenzen in den Primern, die in der Tabelle 1
als "P1/PCR" bezeichnet sind, können auch
zur Verwendung als Standard-PCR-Primer angepasst werden. Wenn diese
Sequenzen als Basis von NASBA-P1-Primern verwendet werden, besitzen
die allgemeine Struktur X1-SEQ, wie oben
definiert. Die Promotor-Sequenz X1 ist in
einem NASBA-P1-Primer
essentiell. Jedoch ist es nicht notwendig, X1 einzuschließen, wenn
dieselben Sequenzen als Basis von Standard-PCR-Primern verwendet
werden.
-
Eine
zweite Art von Primern sind NASBA-Primer 2-Oligonukleotide (hier
auch als NASBA-P2-Primer bezeichnet), welche im Allgemeinen eine
Sequenz von ungefähr
20 Basen umfassn, die im Wesentlichen identisch sind zu einer Region
der Ziel-mRNA. Die in Tabelle 1 als "P2/PCR" aufgeführten Oligonukleotid-Sequenzen
sind zur Verwendung als NASBA-P2-Primer
und Standard-PCR-Primer verwendbar.
-
Oligonukleotide,
die als NSBA-P2-Primer in einer bestimmten, aber nicht darauf beschränkten Ausführungsform
verwendet werden sollen, umfassen ferner eine Sequenz von Oligonukleotiden
am 5'-Ende, welche sich
nicht auf die Ziel-mRNA bezieht, welche jedoch in der Lage ist,
an eine generische Detektionssonde zu hybridisieren. Die Detektionssonde
wird vorzugsweise markiert sein, z.B. mit einer fluoreszierenden,
lumineszierenden oder enzymatischen Markierung. In einer Ausführungsform
ist die Detektionssonde mit einer Markierung markiert, welche die
Detektion unter Verwendung der ECLTM-Technologie
ermöglicht,
obwohl es anerkannt werden muss, dass die Erfindung keinesfalls
auf dieses bestimmte Detektionsverfahren beschränkt werden soll. In einer bevorzugten
Ausführungsform
kann das 5'-Ende
der Primer-2- Oligonukleotide die Sequenz GATGCAAGGTCGCATATGAG umfassen.
Diese Sequenz ist in der Lage, an eine generische ECLTM-Sonde zu
hybridisieren, die kommerziell von Organon Teknika verfügbar ist
und folgende Struktur besitzt:
Ru(bpy)3 2+-GAT GCA AGG TCG CAT ATG AG-3'
-
In
einer anderen Ausführungsform
kann das Primer-2-Oligonukleotid die "molekulare Signal"-Technologie einschließen, die
auf dem Gebiet bekannt ist und beispielsweise in der WO 95/13399
von Tyagi und Kramer, Nature Biotechnology. 14: 303-308, 1996, beschrieben
ist, um eine Echtzeitverfolgung der NASBA-Reaktion zu ermöglichen.
-
Ziel-spezifische
Sonden-Oligonukleotide können
auch in dem Kit enthalten sein. Sonden-Oligonukleotide umfassen im Allgemeinen
eine Sequenz von ungefähr
20-25 Basen, die im Wesentlichen identisch sind zu einer Region
der Ziel-mRNA oder des Komplements davon. Ein Beispiel von HPV-spezifischen
Oligonukleotid-Sequenzen, die zur Verwendung als Sonden geeignet
sind, sind in Tabelle 1 mit "PO" bezeichnet. Die
Sonden-Oligonukleotide können
als Ziel-spezifische Hybridisierungssonden zum Nachweis der Produkte
einer NASBA- oder PCR-Reaktion
verwendet werden. Bei dieser Verbindung können die Sonden-Oligonukleotide an
einen Festträger
wie z.B. paramagnetische Beads gekoppelt werden, um eine Abfangsonde
zu bilden (siehe unten). In einer bevorzugten Ausführungsform
kann das 5'-Ende
des Sonden-Oligonukleotids
mit Biotin markiert sein. Der Zusatz einer Biotin-Markierung ermöglicht die
Verknüpfung
der Sonde an einen Festträger über eine
Biotin-Streptavidin- oder Biotin/Avidin-Verbindung.
-
Ziel-spezifische
Sonden, die eine Echtzeit-Detektion von Amplifikationsprodukten
ermöglichen,
können
in der "molekularen
Signal"-Technologie
eingebaut sein, was auf dem Gebiet bekannt ist und beispielsweise
von Tyagi und Kramer, Nature Biotechnology. 14: 303-308, 1996 und in
WO 95/13399 beschrieben wurde. Beispiele von HPV-spezifischen Sonden-Oligonukleotid-Sequenzen,
die zur Verwendung als molekulare Signalsonden geeignet sind, sind
in Tabelle 1 mit "MB" bezeichnet.
-
Der
Ausdruck "molekulare
Signalsonden", wie
hier verwendet, wird benutzt, um Moleküle mit der Struktur zu bezeichnen:
X2-arm1-Ziel-arm2-X3
worin "Ziel" eine zielspezifische
Sequenz von Nukleotiden bezeichnet, "X2" und "X3" einen fluoreszierenden Rest
und einen Quencher-Rest bezeichnen, der die Fluoreszenz von dem
fluoreszierenden Rest wesentlich oder vollständig löscht, wenn die beiden nahe
zusammengebracht werden, und "arm1" und "arm2" bezeichnen komplementäre Sequenzen,
die zur Bildung einer Stammduplex fähig sind.
-
Bevorzugte
Kombinationen von "arm1" und "arm2"-Sequenzen sind wie
folgt, jedoch sollen diese zur Veranschaulichung dienen und nicht
die Erfindung beschränken:
cgcatg-SEQ-catgcg
ccagct-SEQ-agctgg
cacgc-SEQ-gcgtg
cgatcg-SEQ-cgatcg
ccgtcg-SEQ-cgacgg
cggacc-SEQ-ggtccg
ccgaagg-SEQ-ccttcgg
cacgtcg-SEQ-cgacgtg
cgcagc-SEQ-gctgcg
ccaagc-SEQ-gcttgg
ccaagcg-SEQ-cgcttgg
cccagc-SEQ-gctggg
ccaaagc-SEQ-gctttgg
cctgc-SEQ-gcagg
ccaccc-SEQ-gggtgg
ccaagcc-SEQ-ggcttgg
ccagcg-SEQ-cgctgg
cgcatg-SEQ-catgcg
-
Die
Verwendung der molekularen Signal-Technologie ermöglicht eine
Echtzeit-Verfolgung von Amplifikations-Reaktionen, beispielsweise
einer NASBA-Amplifikation (s. Leone et al., Nucleic Acids Research., 1998,
Bd. 26, S. 2150-2155). Die molekularen Signalsonden umfassen im
Allgemeinen komplementäre
Sequenzen, welche die HPV-spezifische Sequenz flankieren, hier dargestellt
durch den Notations-arm1 und -arm2, die in der Lage sind, aneinander zu hybridisieren,
um eine Stammduplex-Struktur zu bilden. Die präzisen Sequenzen von arm1 und arm2 sind nicht
Gegenstand der Erfindung, außer
dem Erfordernis, dass diese Sequenzen in der Lage sein müssen, eine
Stammduplex zu bilden, wenn die Sonde nicht an eine Ziel-HPV-Sequenz
gebunden ist.
-
Molekulare
Signalsonden umfassen auch einen fluoreszierenden Rest und einen
Quencher-Rest; der fluoreszierende und die Quencher-Reste werden
hier anhand der Abkürzung
X2 und X3 dargestellt.
Der Fachmann wird erkennen, dass die fluoreszierenden und Quencher-Reste
so ausgewählt
sind, dass der Quencher-Rest in der Lage ist, die Fluoreszenz von
dem fluoreszierenden Rest wesentlich oder vollständig zu löschen, wenn die beiden Reste
nahe zusammengebracht werden, z.B. wenn die Sonde in der "geschlossenen" Haarnadelkonformation
in Abwesenheit der Zielsequenz vorliegt. Nach Bindung an die Zielsequenz
werden die fluoreszierenden und Quencher-Reste auseinander gebracht,
so dass die Fluoreszenz des fluoreszierenden Restes nicht länger gelöscht wird.
-
Es
sind viele Beispiele von geeigneten Paaren von Quencher-/fluoreszierenden
Resten entsprechend der vorliegenden Erfindung auf dem Gebiet bekannt
(s. WO 95/13399, Tyagi und Kramer, ibid). Eine Vielzahl von Fluorophoren
in unterschiedlichen Farben kann verwendet werden, einschließlich z.B.
5-(2'-Aminoethyl)Aminonaphtalen-1-Sulphonsäure (EDANS),
Fluoreszein, FAM und Texas Rot (s. Tyagi, Bratu und Kramer, 1998,
Nature Biotechnology, 16, 49-53). Die Verwendung von Sonden, die
mit unterschiedlich gefärbten
Fluorophoren markiert sind, ermöglicht
eine "Multiplex"-Detektion von zwei
oder mehreren unterschiedlichen Sonden in einem einzelnen Reaktionsgefäß. Ein bevorzugter
Quencher ist 4-(4'-Dimethylaminophenylazo)Benzoesäure (DABCYL),
eine nicht fluoreszierende Chromophore, die als ein "universeller" Quencher für eine Vielzahl
von Fluorophoren dient. Die fluoreszierenden und Quencher-Reste
können
kovalent an die Sonde in beliebiger Orientierung gebunden sein;
entweder befindet sich der fluoreszierende Rest am oder in der Nähe des 5'-Ende(s), und der Quencher liegt am oder
in der Nähe
des 3'-Ende(s) oder
umgekehrt. Protokolle zur Synthese von molekularen Signalsonden
sind bekannt. Ein detailliertes Protokoll zur Synthese wird in einem
Dokument mit dem Titel "Molecular
Beacons: Hybridization Probes for Detection of Nucleic Acids in
Homogenous Solutions" von
Sanjay Tyagi et al., Department of Molecular Genetics, Public Health
Research Institute, 455 First Avenue, New York, NY 10016, USA, bereitgestellt,
welches online über
die PHRI-Webseite verfügbar
ist (bei www.phri.nyu.edu oder www.molecular-beacons.org).
-
Geeignete
Kombinationen der NASBA-P1- und NASBA-P2-Primer können verwendet
werden, um eine NASBA-Amplifikationsreaktion zu steuern. Um eine
NASBA-Amplifikationsreaktion
zu steuern, müssen die
Primer 1- und Primer 2-Oligonukleotide in der Lage sein, die Synthese
von einer doppelsträngigen
DNA von einer Zielregion der mRNA einzuleiten. Damit dies erfolgen
kann, müssen
die Primer 1- und Primer 2-Oligonukleotide zielspezifische Sequenzen
umfassen, die komplementär
sind zu Regionen des Sinn- bzw. Antisinn-Stranges der Ziel-mRNA.
-
In
der ersten Phase des NASBA-Amplifikationszyklus, der sogenannten "nicht-zyklischen" Phase lagert sich
das Primer 1-Oligonukleotid an eine komplementäre Sequenz in der Ziel-mRNA an, und dessen 3'-Ende wird durch
die Akivität
einer RNA-abhängigen
DNA-Polymerase verlängert
(z.B. reverse Transkriptase), um eine Erststrang-cDNA-Synthese auszulösen. Der
RNA-Strang des entstehenden RNA:DNA-Hybrids wird dann gespalten,
beispielsweise durch die Wirkung von RNaseH, um einen einzelnen
Strang DNA zu überlassen.
Das Primer 2-Oligonukleotid
lagert sich an die komplementäre
Sequenz gegen das 3'-Ende
dieser einzelsträngigen
DNA an, und dessen 3'-Ende
wird (durch die Wirkung einer reversen Transkriptase) verlängert, um
eine doppelsträngige
DNA zu bilden. Die RNA-Polymerase ist dann in der Lage, mehrere
RNA-Kopien aus der nun transkriptionsaktiven Promotor-Sequenz innerhalb
der doppelsträngigen
DNA zu transkribieren. Dieses RNA-Transkript, welches zu der ursprünglichen
Ziel-mRNA in Antisinn-Orientierung ist, kann als eine Matrize für eine weitere
Runde von NASBA-Reaktionen dienen, wobei der Primer 2 sich an die
RNA anlagert und die Synthese des ersten cDNA-Stranges und der Primer
2 die Synthese des zweiten cDNA-Stranges
einleitet. Die generellen Prinzipien der NASBA-Reaktion sind auf
dem Gebiet bekannt (s. Compton, J. Nature. 350: 91-92).
-
Die
hier beschriebenen Ziel-spezifischen Sonden-Oligonukleotide können auch
an einen Festträger gebunden
werden, wie z.B. magnetische Mikrobeads, und als "Abfangsonden" verwendet werden,
um das Produkt der NASBA-Amplifikationsreaktion zu immobilisieren
(eine einzelsträngige
RNA). Die hier beschriebenen, Ziel-spezifischen "molekularen Signal"-Sonden können für eine Echtzeitverfolgung der
NASBA-Reaktion verwendet werden.
-
Die
Kits können
auch eine Positiv-Kontrolle einschließen, die E6 und/oder L1-mRNA
einer bekannten HPV-Art enthalten. Geeignete Kontrollen umfassen
beispielsweise Nukleinsäureextrakte,
die von Zelllinien präpariert
wurden, die mit bekannten HPV-Arten infiziert sind (z.B. HeLa, CaSki).
-
Die
Kits können
weiter interne Kontroll-Amplifikations-Primer enthalten, z.B. Primer,
die für
menschliche U1A RNA spezifisch sind.
-
Kits,
die Primer (und ggf. Sonden) enthalten, die zur Verwendung in der
NASBA-Amplifikation
geeignet sind, können
ferner ein Gemisch von Enzymen umfassen, das für die NASBA-Reaktion erforderlich
ist, z.B. ein Enzymgemisch, das eine RNA-gesteuerte DNA-Polymerase (z.B.
eine reverse Transkriptase), eine Ribonuklease, welche den RNA-Strang
eines RNA-DNA-Hybrids ohne Hydrolyse einzelsträngiger oder doppelsträngiger RNA
oder DNA hydrolisiert (z.B. RNaseH) und eine RNA-Polymerase enthalten.
Die RNA-Polymerase sollte eine sein, welche die in der terminierten
5'-Region vorliegende
Promotor-Sequenz der NASBA-P1-Primer, die in dem Reaktionskit bereitgestellt
werden, erkennt. Der Kit kann auch einen Vorrat des NASBA-Puffers
umfassen, der die Ribonukleoside und Desoxyribonukleoside enthält, die
für die
RNA- und DNA-Synthese erforderlich sind. Die Zusammensetzung eines
Standard-NASBA-Reaktionspuffers ist für den Fachmann bekannt (s.
auch Leone et al., ibid).
-
Tabelle
1: E6-spezifische Sequenzen zum Einbau in NASBA/PCR-Primern und
Sonden
-
-
-
-
Tabelle
2: L1-spezifische Sequenzen zum Einbau in NASBA/PCR-Primern und
Sonden
-
Bevorzugte
Primer, die zur Verwendung für
den Nachweis von HPV L1- und E6-mRNA durch NASBA geeignet sind,
sind in den folgenden Tabellen aufgeführt. Jedoch dienen diese lediglich
zur Veranschaulichung und sollen den Umfang der Erfindung nicht
auf diese spezifischen Moleküle
beschränken.
-
In
den folgenden Tabellen umfassen die NASBA-P2-Primer (p2) die Sequenz
GATGCAAGGTCGCATATGAG am 5'-Ende;
die NASBA-P1-Primer(p1) umfassen die Sequenz AATTCTAATACGACTCACTATAGGGAGAAGG
am 5'-Ende. Oligonukleotide,
die zur Verwendung als Sonden geeignet sind, werden mit "po" bezeichnet. Die
p2-Primer enthalten im Allgemeinen HPV-Sequenzen von dem positiven
Strang, wohingegen die p1-Primer im Allgemeinen HPV-Sequenzen von
dem Negativstrang enthalten. Nt bezeichnet die Nukleotidposition
in der relevanten genomischen HPV-Sequenz.
-
Tabelle
3: Bevorzugte E6-NASBA-Primer und Sonden
-
-
-
-
-
-
-
Paare
von P1- und P2-Primern mit demselben Präfix (z.B. Hae6701p1 und Hae6701p2)
sind zur Verwendung in Kombination vorgesehen. Jedoch können auch
andere Kombinationen verwendet werden, wie unten zusammengefasst
für die
HPV-Arten 16, 18, 31, 33 und 45.
-
Geeignete
Primerpaare zur Amplifikation von HPV 16 E6-mRNA sind wie folgt:
Hae6701p2
oder Hae6702p2 (beide Nt 166) mit Hae6701p1 oder Hae6702p1 (beide
Nt 368).
Hae6701p2 oder Hae6702p2 (beide Nt 116) mit HPV16p1
(Nt 258).
H16e6702Ap2 (Nt 142), H16e6702Bp2 (Nt 182), H16e6702Cp2
(Nt 185) oder H16e6702Dp2 (Nt 188) mit Hae6701p1 oder Hae6702p1
(beide Nt 368).
-
Hae6701p2
oder Hae6702p2 (beide Nt 116) mit Hae6702Ap1 (Nt 208), Hae6702Bp1
(Nt 191), Hae6702Dp1 (185). Diese Kombinationen sind zur Amplifikation
von sämtlichen
E6-Spleiß-Varianten geeignet.
-
Hae6703p2
oder Hae6704p2 (beide Nt 656) mit Hae6703p1 oder Hae6704p1 (beide
Nt 741). Diese Kombinationen sind zur Amplifikation von sämtlichen
Transkripten, welche die kodierende E7-Region enthalten (wenigstens
bis zu Nt 741), geeignet.
-
Die
folgenden Primer-Paare sind zur Amplifikation von HPV-18-E6-mRNA
bevorzugt:
H18e6701p2 (Nt 702) oder H18e6702p2 (Nt 698) mit
H18e6701p1 oder H18e6702p1 (beide Nt 869).
H18e6703p2 (Nt 651)
mit H18e6703p1 (Nt 817).
H18e6704p2 (Nt 179) mit H18e6704p1
(Nt 379).
-
Die
folgenden Primer-Paare sind zur Amplifikation von HPV 31 E6-mRNA
bevorzugt:
H31e6701p2 oder H31e6702p2 (beide Nt 164) mit H31
e6701p1 oder H31e6702p1 (beide Nt 423).
H31e6703p2 (Nt 617),
H31e6704p2 (Nt 619) oder H31e6705p2 (Nt 617) mit H31e6703p1 (Nt
766), H31e6704p1 (766) oder H31e6705p1 (Nt 809).
-
Die
folgenden Primer-Paare sind zur Amplifikation von HPV 33 E6-mRNA
bevorzugt:
H33e6701p2 (Nt 618) oder H33e6703p2 (Nt 620) mit
H33e6701p1 (Nt 763) oder H33e6703p1 (Nt 807).
H33e6702p2 (Nt
431) mit H33e6702p1 (Nt 618).
-
Das
folgende Primer-Paar ist zur Amplifikation von HPV 45 bevorzugt:
HPV45p2
(Nt 430) mit HPV45p1 (Nt 527).
-
-
-
-
Bevorzugte
PCR-Primer-Paare für
HPV-Arten 16, 18, 31 und 33 sind analog zu den NASBA-Primer-Paaren.
-
Tabelle
5: Bevorzugte L1-NASBA-Primer und Sonden
-
-
Tabelle
6 – Bevorzugte
L1 PCR-Primer
-
Die
HPV-spezifischen Sequenzen in SEQ ID Nos. 149 und 150 (Primer Onc2A2/Onc2A1-PCR und Onc2A1/Onc2A2-PCR)
sind identisch zu den Fragmenten der genomischen Sequenz von HPV-Art
16 an der Position 6596 – 6615
(SEQ ID NO:149; Onc2A2/Onc2A1-PCR), und von der Position 6729 bis
6747 (SEQ ID NO:150; Onc2A1/Onc2A2-PCR).
-
Die
HPV-spezifischen Sequenzen SEQ ID Nos:152 und 153 (Onc2B2/Onc2B1-PCR
bzw. Onc2B1/Onc2B2-PCR) sind Varianten der oben genannten Sequenzen,
einschließlich
mehrerer degenerierter Basen. Darstellungen der Sequenzen von hier
bereitgestellten degenerierten Oligonukleotid-Molekülen verwenden
den Standard-IUB-Code für
gemischte Basenstellen: N=G,A,T,C; V=G,A,C; B=G,T,C; H=A,T,C; D=G,A,T;
K=G,T; S=G,C; W=A,T; M=A,C; Y=C,T; R=A, G.
-
Es
ist auch möglich,
Varianten der HPV-spezifischen Sequenzen SEQ ID NO:152 (Onc2B2/Onc2B1-PCR)
und SEQ ID NO:153 (Onc2B1/Onc2B2-PCR) zu verwenden, worin beliebige
zwei Nukleotide "SRH" gegen das 3'-Ende der Sequenz
mit Inosin (I) ersetzt werden können,
wie folgt:
5' AATGGCATTTGTTGGIIHAA
3'
5' AATGGCATTTGTTGGSIIAA
3'
5' AATGGCATTTGTTGGIRIAA
3'
-
Die
HPV-spezifischen Sequenzen SEQ ID NOs: 156-163 (vorhanden in Primern
Onc2C2, Onc2D2, Onc2E2, Onc2F2, Onc2G2, Onc2H2, Onc2I2, Onc2J2,
Onc2C1-PCR, Onc2D1-PCR, Onc2E1-PCR, Onc2F1-PCR, Onc2G1-PCR, Onc2H1-PCR,
Onc2I1-PCR und Onc2J1-PCR) sind Varianten basierend auf der HPV-spezifischen
Sequenz SEQ ID NO:152 (Onc2B2/Onc2B1-PCR), in denen die HPV-spezifischen
Sequenzen SEQ ID NOs: 164-169 (vorhanden in Primern Onc2K1, Onc2L1,
Onc2M1, Onc2N1, Onc2O1, Onc2P1, Onc2K2-PCR, Onc2L2-PCR, Onc2M2-PCR,
Onc2N2-PCR, Onc2O2-PCR und Onc2P2-PCR Varianten sind, die auf der
HPV-spezifischen Sequenz SEQ ID NO:153 (Onc2B1/Onc2B2-PCR) basieren.
Diese Varianten umfassen degenerierte Basen und auch Inosin (I)-Reste.
Diese Sequenzvariation ermöglicht,
dass Oligonukleotide, welche die Variantensequenzen eingebaut haben,
an mehrere HPV-Arten binden. Inosinbasen interferieren nicht mit
der Hybridisierung und können
so an Variationsstellen zwischen HPV-Arten angeschlossen sein, um
einen "Konsensus"-Primer zu konstruieren,
der zur Bindung an mehrere HPV-Arten fähig ist.
-
Einer
oder mehrere der Primer Onc2A2, Onc2B2, Onc2C2, Onc2D2, Onc2E2,
Onc2F2, Onc2G2, Onc2H2, Onc2I2 und Onc2J2 können in Kombination mit einem
oder mehreren der Primer Onc2A1, Onc2B1, Onc2K1, Onc2L1, Onc2M1,
Onc2N1, Onc2O1 und Onc2P1 zur NASBA-Amplifikation von HPV-L1-mRNA
verwendet werden.
-
Einer
oder mehrere der Primer Onc2A1-PCR, Onc2B1-PCR, Onc2C1-PCR, Onc2D1-PCR, Onc2E1-PCR,
OncF1-PCR, Onc2G1-PCR, Onc2H1-PCR, Onc2I1-PCR und Onc2J1-PCR können in
Kombination mit einem oder mehreren der Primer Onc2A2-PCR, Onc2B2-PCR,
Onc2K2-PCR, Onc2L2-PCR, Onc2M2-PCR, Onc2N2-PCR, Onc2O2-PCR und Onc2P2-PCR
zur PCR-Amplifikation von HPV-L1 verwendet werden.
-
Die
Erfindung wird unter Bezugnahme auf die folgenden experimentellen
Beispiele und Zeichnungen näher
beschrieben, in denen:
-
1 die Ergebnisse eines Einzelreaktion-Echtzeit-NASBA-Assays
unter Verwendung eines molekularen FAM-Signals für HPV 16 mit einer Patientenprobe
zeigt, während 1B einen Multiplex-Echtzeit-NAABA-Assay zeigt,
unter Verwendung des molekularen FAM-Signals von 1A und eines molekularen Signals, das mit Texas-Rot
für UIA
markiert ist,
-
2A einen Einzelreaktion-Echtzeit-NASBA mit einem
molekularen FAM-Signal für
HPV 18 mit einer Patientenprobe zeigt, während 2B eine
Multiplex-Version mit einem Texas-Rot-markierten molekularen Signal für HPV 18
und einem FAM-markierten Signal für HPV 33 zeigt,
-
3A einen Einzelreaktion-Echtzeit-NASBA mit einem
HPV 31 FAM-markierten molekularen Signal zeigt, während 3B eine Multiplex-Version ist, die ein HPV 45
Texas-Rot-markiertes
molekulares Signal einschließt,
-
4A einen Einzelreaktion-Echtzeit-NASBA mit einem
HPV 33 FAM-markierten molekularen Signal zeigt, während 4B eine Multiplex-Version ist, die ein Texas-Rot-markiertes molekulares
HPV-18-Signal einschließt,
-
5A einen Einzelreaktion-Echtzeit-NASBA mit einem
HPV 45 FAM-markierten molekularen Signal zeigt, während 5B die Multiplex-Version zeigt, die ein HPV 45
Texas-Rot-markiertes
molekulares Signal und ein FAM-markiertes molekulares HPV-31-Signal
einschließt,
und
-
6 HPV,
detektiert durch PreTect HPV-Proofer und PCR im Vergleich zur Zytologie
oder Histologie zeigt.
-
Beispiel 1 – Nachweis
von HPV-mRNA durch auf NASBA basierende Nukleinsäure-Amplifikation und Echtzeit-Detektion
-
Sammlung und Präparation
klinischer Proben
-
Pap-Abstriche
und HPV-Proben wurden von 5970 Frauen in dem zervikalen Durchmusterungsprogramm
in Oslo, Norwegen, gesammelt. Die Proben, die zur RNA/DNA-Extraktion vorgesehen
sind, wurden wie folgt behandelt:
Die Zervixproben wurden von
jeder Frau, die an dem Zervix-Durchmusterungsprogramm teilnahm,
unter Verwendung einer Zytobürste
(Rovers Medical Devices, The Netherlands) gesammelt. Die Zytobürste wurde
dann in 9 ml Lysepuffer eingetaucht (5M Guanidinthiocyanat). Da
RNA am besten in 5M Guanidinthiocyanat bei –70° geschützt ist, wurde lediglich 1
ml Gesamtvolumen Probe für
jede Extraktionsrunde verwendet. Die Proben in Lysepuffer wurden
bei –20° C für nicht
mehr als eine Woche gelagert, dann bei –70°C bis zur Isolierung von DNA/RNA
gelagert.
-
RNA
und DNA wurden automatisch von 5300 Frauen in der ersten Extraktionsrunde
isoliert unter Verwendung von 1 ml der Gesamtprobe von 9 ml Lysepufter.
RNA und DNA wurden gemäß dem "Booms"-Isolierungsverfahren
von Organon Teknika (Organon Teknika B.V., Boselind 15, P.O. Box
84, 5280 AB Baxtel, Niederlande; jetzt Biomerieux, 69280 Marcy I'Etoile, Frankreich),
unter Verwendung des NuclisensTM-Extraktors, dem
Protokoll für
eine automatisierte Extraktion folgend, extrahiert.
-
Zelllinien
-
DNA
und RNA von HeLa (HPV 18), SiHa (HPV 16) und CaSki (HPV 16) Zelllinien
wurden als Positivkontrollen für
die PCR- und NASBA-Reaktion verwendet. Diese Zellen wurden auch
als Probenmaterial in der Sensitivitätsstudie verwendet (Beispiel
2). SiHa-Zellen haben 1-2 Kopien HPV-16 pro Zelle integriert, während CaSki-Zellen
zwischen 60-600 Kopien HPV 16 sowohl im integrierten als auch im
episomalen Zustand haben. HeLa-Zellen haben ungefähr 10-50 Kopien HPV 18
pro Zelle.
-
HPV-Detektion
und -Bestimmung durch PCR
-
Isolierte
DNA von zervikalen Abstrichen wurde einer PCR unter Verwendung der
Konsensus GP5+/6+-Primer (EP-B-0 517 704) ausgesetzt. Die PCR wurde
in 50 μl
Reaktionsvolumen, enthaltend 75 mM Tris-HCl (pH 8,8 bei 25° C), 20 mM
(NH4)2SO4, 0,01 Tween 20TM,
200 mM jeweils dNTP, 1,5 mM MgCl2, 1 U rekombinante
Taq-DNA-Polymerase (MBI-Fermentas), 3 μl DNA-Probe und 50 pmol von
jedem GP5+- und GP6+-Primer durchgeführt. Ein zweiminütiger Denaturierungsschritt
wurde bei 94° C,
gefolgt von 40 Amplifikationszyklen mit einem PCR-Prozessor durchgeführt (Primus
96, HPL-Block, MWG, Deutschland). Jeder Zyklus umfasste einen Denaturierungsschritt
von einer Minute, einen Primer-Anlagerungsschritt bei 40° C für 2 Minuten
und einen Kettenverlängerungsschritt
bei 72° C
für 1,5
Minuten. Der endgültige
Elongationsschritt wurde um 4 Minuten verlängert, um eine vollständige Verlängerung
der amplifizierten DNA sicherzustellen.
-
Die
GP5+/6+-positiven Proben wurden den Protokollen für die HPV-Arten
16, 31 und 33 wie folgt ausgesetzt: HPV 16, 31 und 33: die PCR wurde
in 50 μl
durchgeführt,
enthaltend 75 mM Tris-HCl 8pH 8,8 bei 25° C), 200 mM von jedem dNTP,
1,5 mM MgCl2, 2,5 U-rekombinante Taq-DNA-Polymerase (MBI
Fermentas), 3 μl
DNA-Probe und 25 pmol von jedem Primer. Ein zweiminütiger Denaturierungsschritt
bei 94° C,
gefolgt von 35 Amplifikationszyklen mit einem PCR-Prozessor (Primus
96, HPL-Block, MWG, Deutschland), wurde durchgeführt. Jeder Zyklus umfasste
einen Denaturierungsschritt bei 30 Sek., einen Primer-Anlagerungsschritt
bei 57° C
für 30
Sek. und einen Kettenverlängerungsschritt
bei 72° C
für 1 Minute.
Der endgültige
Elongationsschritt wurde um 10 Min. verlängert, um eine Bd.lständige Verlängerung
der amplifizierten DNA sicherzustellen. Das Protokoll für HPV 33
sieht einen Primer-Anlagerungsschritt bei 52° C vor. HPV 18 Protokoll: die
Primer wurden konstruiert, um HPV-Art 18 nachzuweisen. Die PCR wurde
in 50 μl
durchgeführt,
enthaltend 75 mM Tris-HCl (ph 8,8 bei 25° C), 20 mM (NH4)2SO4, 0,01 % Tween
20, 200 mM jeweils dNTP, 2,0 mM MgCl2, 2,5 U-rekombinante
Taq-DNA-Polymerase (MBI-Fermentas), 3 μl DNA-Probe und 25 pmol von
jedem Primer. Ein zweiminütiger
Denaturierungsschritt wurde bei 94° C, gefolgt von 35 Amplifikationszyklen
mit einem PCR-Prozessor durchgeführt
(Primus 96, HPL-Block, MWG, Deutschland). Jeder Zyklus umfasste
einen Denaturierungsschritt von 30 Sek., einen Primer-Anlagerungsschritt
bei 57° C
für 30
Sek. und einen Kettenverlängerungsschritt
bei 72° C
für 1 Minute.
Der endgültige
Elongationsschritt wurde um 10 Minuten verlängert, um eine vollständige Verlängerung
der amplifizierten DNA sicherzustellen.
-
Der
gegen das humane β-Globin-Gen
gerichtete Primersatz wurde als Kontrolle für die DNA-Qualität verwendet
(Operating procedure, University Hospital Vrije Universiteit, Amsterdam,
Niederlande). Die PCR wurde durchgeführt in 50 μl, enthaltend 75 mM Tris-HCl
(pH 8,8 bei 25° C),
200 mM von jedem dNTP, 1,5 mM MgCl2, 1 U
rekombinante Taq DNA-Polymerase
(MBI Fermentas), 3 μl
DNA-Probe und 25 pmol von jedem Primer. Ein zweiminütiger Denaturierungsschritt
bei 94° C,
gefolgt von 35 Amplifikationszyklen mit einem PCR-Prozessor (Primus
96, HPL Block, MWG, Deutschland) wurde durchgeführt. Jeder Zyklus umfasste
einen Denaturierungsschritt bei 94° C für 1 Minute, einen Primeranlagerungsschritt
bei 55° C
für 1 %
Min. und einen Kettenverlängerungsschritt
bei 72° C
für 2 Minuten.
Der endgültige
Verlängerungsschritt
wurde um 4 Min. verlängert,
um eine vollständige
Verlängerung
der amplifizierten DNA sicherzustellen. HeLa wurden als Positivkontrollen
für HPV
18 verwendet, während
SiHa oder CaSki als Positivkontrolle für HPV 16 verwendet wurden. Wasser
wurde als Negativkontrolle verwendet.
-
Primer,
die für
die HPV PCR verwendet wurden:
-
Die
Visualisierung der PCR-Produkte wurde auf einem DNA-500-Chip entsprechend
dem Handbuch durchgeführt
(Agilent Technologies, USA). Der DNA-Chip verwendet eine Mikroskalengel-Elektrophorese
mit einem optimalen Detektionslimit von 0,5 bis 50 ng/ml. Die Ergebnisse
wurden unter Verwendung der Bioanalyser 2100 Software ausgewertet
(Agilent Technologies, USA).
-
Die
folgende Tabelle stellt die Primer dar, die für die HPV-PCR in Patientenproben
verwendet wurden und gibt zusätzliche
PCR-Primer an, die für
HPV 35, 39, 45, 51, 52, 58 und HPV 6/11 verwendbar sind.
-
PCR-Primer
zur Detektion von HPV
-
NASBA-RNA-Amplifikation
-
Vorkehrungen zur Vermeidung
einer Kontamination:
-
- 1. Durchführung
einer Nukleinsäure-Freisetzung,
Isolierung und Amplifikation/Detektion in getrennten Laborbereichen.
- 2. Lagerung und Herstellung von Reagenzien zur Nukleinsäure-Freisetzung,
Isolierung und Amplifikation/Detektion in den Laborbereichen, in
denen eine Nukleinsäure-Freisetzung,
Isolierung und Amplifikation/Detektion durchgeführt wird.
- 3. Sämtliche
Behälter
und Gefäße sollen
geschlossen sein, wenn sie nicht verwendet werden.
- 4. Pipetten und anderes Werkzeug, das in einem Laborbereich
verwendet wurde, dürfen
nicht in anderen Bereichen verwendet werden.
- 5. Verwendung einer frischen Pipette oder Pipettenspitze für jede Pipettieraktion.
- 6. Verwendung von Pipetten mit aerosolresistenten Spitzen für Fluide,
die möglicherweise
Nukleinsäure enthalten.
Die Pipettierung der Lösung
muss jedes Mal aus oder in ein isoliertes Gefäß erfolgen, das speziell für diese
Aktion geöffnet
und geschlossen wird. Alle anderen Röhrchen und Gefäße sollten
geschlossen bleiben und von den zu behandelnden Röhrchen und
Gefäßen getrennt
werden.
- 7. Verwendung von Wegwerf-Handschuhen bei Arbeit mit klinischem
Material, das möglicherweise Ziel-RNA
oder amplifiziertes Material enthält. Wenn möglich, Handschuhwechsel nach
jedem Pipettierschritt in der Testprozedur, insbesondere nach Kontakt
mit möglicherweise
kontaminiertem Material.
- 8. Sammeln von verwendetem wegwerfbarem Material in einem Behälter. Verschließen und
Entfernen des Behälters
nach jedem Testlauf.
- 9. Eintauchen von Röhrchenständern, die
während
der Nukleinsäureisolierung
oder Amplifikation/Detektion verwendet wurden, in ein Detergenz
(z.B. Merck Extran MA01 Alkali) für wenigstens eine Stunde nach
jedem Testlauf.
-
Die
folgende Prozedur wurde durchgeführt
unter Verwendung von Reagenzien von NuclisensTM Basic Kit,
zur Verfügung
gestellt von Organon Teknika.
-
Prozedur für n=10 Proben:
-
1. Herstellung der Enzymlösung:
-
Hinzufügen von
55 μl Enzymverdünnung (von
NuclisensTM Basic Kit, enthält Sorbitol
in wässriger
Lösung)
zu jeder der 3 lyophylisierten Enzymsphären (von NuclisensTM Basic
Kit; enthält
AMV-RT, RNase H, T7 RNA Polymerase und BSA). Belasse dieser Enzymlösung für wenigstens
20 Min. bei Raumtemperatur. Überführen der
Enzymlösungen
in ein Röhrchen,
gutes Vermischen durch Antippen des Röhrchens mit dem Finger, kurzes
Abzentrifugieren und Verwendung innerhalb einer Stunde. Endkonzentrationen
in dem Enzymmix sind 375 mM Sorbitol, 2,5 μg BSA, 0,08 U RNase H, 32 U
T7 RNA Polymerase und 6,4 U AMV-reverse Transkriptase.
-
2. Herstellung der Reagenzspähren-/KCl-Lösung
-
Für 10 Proben:
Hinzufügen
von 80 μl
Reagenzsphärenverdünnung (von
NuclisensTM Basic Kit; enthält Tris/HCl
(pH 8,5), 45 % DMSO) zu der lyophylisierten Reagenzsphäre (von
NuclisensTM Basic Kit; enthält Nukleotide,
Dithiotreitol und MgCl2) und unmittelbaren
guten Vortexen. Führe
dies mit 3 Reagenzsphären
durch und mische die Lösungen
in ein Röhrchen.
-
Hinzufügen von
3 μl NASBA-Wasser
(von NuclisensTM Basic Kit) zu der rekonstituierten
Reagenzsphärenlösung und
gutes Vermischen.
-
Hinzufügen von
56 μl der
KCl-Stammlösung
(von NuclisensTM Basic Kit) und gutes Vermischen.
Die Verwendung dieses KCl/Wasser-Gemisches wird NASBA-Reaktionen
mit einer KCl-Endkonzentration
von 70 mM ergeben. Die Endkonzentrationen in der Reagenz/KCl-Lösung sind
1 mM für
jedes dNTP, 2 mM ATP, UTP und CTP, 1,5 mM GTP und 0,5 mM ITP, 0,5
mM Dithiotreitol, 70 mM KCl, 12 mM MgCl2,
40 mM Tris-HCl (pH 8,5).
-
3. Herstellung der Primer-/Sondenlösung, die
zielspezifische Primer und eine molekulare Signalsonde enthält.
-
Für jede Zielreaktion
wurden 91 μl
der Reagenzspähren/KCl-Lösung (hergestellt
in Schritt 2) in ein frisches Röhrchen überführt. Hinzufügen von
25 μl der
Primer/molekularen Signalsondenlösung
(um eine Endkonzentration von ungefähr 0,1-0,5 μM für jeden der Sinn- und Antisinn-Primer
und ungefähr
15-70 pmol der molekularen Signalsonde pro Reaktion zu ergeben).
Gutes Vermischen durch Vortexen, kein Zentrifugieren.
-
Für den Fall,
dass weniger als 10 Ziel-RNA-Amplifikationen durchgeführt wurden,
bezieht man sich auf die Tabelle unten für die geeigneten Mengen von
Reagenzspährenlösung, KCl-Wasserlösung und
der zu verwendenden Primer. Die Primer-Lösungen sollten innerhalb von
30 Minuten nach deren Präparation
verwendet werden.
-
-
-
4. Zusatz von Proben
-
Für jede Ziel-RNA-Reaktion:
-
Zu
jeder Mikrotiter-Platten mit 96 Vertiefungen wurden 10 μl der Primer-/Sondenlösung (hergestellt
in Schritt 3) in jede der 10 Vertiefungen pipettiert. Hinzufügen von
5 μl Nukleinsäureextrakt
zu jeder Vertiefung. Inkubieren der Mikrotiter-Platte für 4 Min.
bei 65 ± 1 ° C. Abkühlen ab
auf 41 ± 0,5° C für 4 Min.
Dann Hinzufügen
von 5 μl
Enzymlösung
zu jeder Vertiefung. Gib die Mikrotiter-Platte unverzüglich in
ein Fluoreszenz-Detektions-Gerät
(z.B. NucliSensTM EasyQ Analyzer) und starte
die Amplifikation.
-
Ergebnisse
der klinischen Studie
-
Tabelle
7 zeigt die Verteilung von Echtzeit-NASBA HPV-positiven (L1- und/oder
E6-Expression) und PCR-HPV-positiven
Fällen
bezogen auf zytologische Ergebnisse. Die PCR-Amplifikation wurde durchgeführt wie
beschrieben von Karlsen et al., J Clin Microbiol. 34: 2095-2100, 1996. Die Figuren
für die
erwartete Histologie basieren auf Durchschnittsergebnissen einer ähnlichen
Studie von CIN III-Läsionen
(Clavel et al., Br J Cancer, 84: 1616-1623, 2001). Die Ergebnisse
von mehreren Beispielfällen
sind in Tabelle 8 aufgeführt.
-
-
-
Beispiel 2: Empfindlichkeit
der Echtzeit-NASBA auf Kontrollzelllinien
-
Zervikale
Krebszelllinien, CaSki, SiHa und HeLa wurden in Lyse-Puffer entweder
vor der automatisierten Extraktion von Nukleinsäuren unter Verwendung des Boom's Extraktions-Verfahrens von Organon
Teknika/bioMerieux (Parallelen 1 und 3) oder nach der Nukleinsäure-Extraktion (Parallele
2) verdünnt.
Der Echtzeit-NASBA wurde unter Verwendung von molekularen Signalsonden
durchgeführt,
die mit Texas-Rot (16, L1 und 18) oder FAM (U1A, 33 und 31) entsprechenden
dem oben beschriebenen Protokoll markiert waren.
-
-
Somit
ist es möglich,
HPV E6 mRNA in weniger als einer Zelle unter Verwendung von Echtzeit-NASBA nachzuweisen.
-
Der
Echtzeit-NASBA wurde sowohl als ein gebündelter Assay als auch in Einzelreaktionen
getestet. Die Ergebnisse der folgenden Sensitivitätsstudie
basieren auf parallelen Läufen
mit CaSki-, SiHa- und HeLa-Zelllinien sowie auf drei parallelen
Läufen
mit synthetischen DNA-Oligos
für die
HPV-Art 16, 18, 31 und 33. Die Festlegung der Detektionsgrenze besteht
darin, dass beide Proben in der Parallelen positiv sind. Die Zahl in
Klammern (x) bezeichnet, dass die spezifizierte Menge von Zellen
auch in einigen Läufen
nachgewiesen worden ist. Die Empfindlichkeit wird als die Menge
von Zellen definiert, die für
die Detektion von HPV in zwei parallelen Läufen notwendig ist. Die HPV-Arten
werden durch PCR bestimmt, und die Spezifität basiert auf NASBA im Vergleich
zur PCR.
-
Sensitivität
-
PCR:
die HPV-Konsensus-PCR unter Verwendung von Gp5+/6+ detektierte lediglich
bis zu 104 SiHA- und HeLa-Zellen und bis
zu 103 CaSki-Zellen. Jedoch waren die artspezifischen
PCR-Primer-Sätze sensitiver und
detektierten 103 (102)
SiHa-Zellen und 0,1 CaSki-Zellen für den HPV 16 artspezifischen
PCR-Primer-Satz, während
der HPV 18 artspezifische PCR-Primer-Satz 102-Zellen
nachwies.
-
Echtzeit-NASBA:
Echtzeit-NASBA mit Primern, die spezifisch für U1A sind, führte zum
Nachweis von 10 (1) SiHa- und CaSki-Zellen und einer HeLa-Zelle
in dem Reaktionsgemisch.
-
Für die HPV16-spezifischen
Primer war das untere Detektionslimit (10) (102,
1) SiHa-Zellen und 10 (1) CaSki-Zellen, und bei den HPV18-spezifischen
Primern war das Detektionslimit 1 (0,1) HeLa-Zellen. Die universellen
L1-Primer führten
zum Nachweis von 10 CaSki-Zellen. HeLa-Zellen und SiHa-Zellen wurden mit dem universellen
L1-Primer nicht nachgewiesen.
-
Echtzeit-Multiplex-NASBA
mit den U1A-spezifischen Primern hatte ein niedriges Detektionslimit
von 102(10) SiHa-Zellen und 10(1) CaSki-Zellen
bei Kombination mit den HPV16-spezifischen Primern, welche ein niedrigeres
Detektionslimit für
10(1) SiHa und 10(1) CaSki-Zellen hatten. Die L1-spezifischen Primer
in Kombination mit den HPV33-spezifischen Primern führte zum
Nachweis von 103(102) CaSki-Zellen. Es war
keine konkurrierende HPV33-Probe in der Reaktion. Bei den HPV18-spezifischen
Primern war das niedrigere Detektionslimit 1 (0,1) HeLa-Zellen bei Kombination
mit den HPV31-spezifischen Primern. Es war keine konkurrierende
HPV31-Probe in der Reaktion. Die Empfindlichkeit der HPV31- und
HPV33-spezifischen Primern wurde aufgrund des Fehlens von Zelllinien,
welche diese HPV-Arten beherbergen, nicht getestet. Sie wurden gegen Proben
getestet, die HPV 31 und HPV 33 enthalten, jedoch war die Anzahl
der Zellen und die Kopienzahl von HPV 31 und HPV 33 in diesen Zellen
unbekannt und variierte vermutlich in unterschiedlichen Proben.
-
Tabelle
10: Sensitivität
von Echtzeit-NASBA im Vergleich zu PCR
-
Echtzeit-NASBA
wurde mit Proben von Frauen durchgeführt, die vom Ostfold Central
Krankenhaus stammten, zur Behandlung von CIN im Zeitraum von 1999-2001
(s. Beispiel 3). Molekulare Signalsonden, die mit FAM oder Texas-Rot
markiert waren, wurden zusammen mit der Nukleinsäure-Extraktion und den oben
beschriebenen NASBA-Protokollen verwendet. Die Ergebnisse sind in 1A und 1B gezeigt
(HPV 16 – Patientenprobe
205), 2A und 2B (HPV
18 – Patientenprobe
146), 3A und 3B (HPV
31 – Patientenprobe
236), 4A und 4B (HPV
33 – Patientenprobe
218) und 5A und 5B (HPV
45 – Patientenprobe
343). In jedem Fall bezieht sich die "A"-Figur
auf eine Einzelreaktion, während
sich die "B"-Figur auf den Multiplex-Assay
bezieht.
-
Spezifität: Die Kreuzreaktivität von Echtzeit-NASBA.
-
Echzeit-NASBA-Primer-Kombinationen
wurden gegen 490 Zervixproben von der Oslo-Studie getestet, die
mit PCR für
HPV 6/11, 16, 18, 31, 33, 35, 39, 45, 51, 52, 58 oder HPV X positiv
waren, um eine Kreuzreaktivität
zwischen den HPV-Arten unter Verwendung von NASBA zu überprüfen. Alle
Proben wurden durch Konsensus-PCR und einer artspezifischen PCR
für die
jeweiligen HPV-Arten charakterisiert, außer für die HPV-Art 39(2), 52(1)
und 58(2). Diese Proben wurden zum Test gegen PreTect-HPV-Proofer
hinzugefügt.
HPV X sind positiv für
die Konsensus Gp5+/6+-PCR, jedoch negativ für HPV6/11, 16, 18, 31, 33,
35, 45 und 51 durch artspezifische PCR. Die Ergebnisse sind in Tabelle
14 gezeigt. Es wurde keine Kreuzreaktivität gezeigt. Der Sequenznachweis
für eine
ausgewählte
Anzahl von Fällen
aus Tabelle 14 ist in Tabelle 14a gezeigt.
-
PCR:
insgesamt wurden 773 Zervixproben mit PCR und dem PreTect HPV-Proofer
getestet (Echtzeit-Multiplex-NASBA), und insgesamt 24,6 % (190/773)
Proben waren positiv mit den Gp5+/6+-Konsenus-PCR-Primern. 74,1
% (83/112) wurden als HPV 16, 13 % (15/112) als HPV 18, 17 % (19/112)
als HPV 31 und 12 % (13/112) als HPV 33 eingeordnet, einschließlich multipler
HPV-Infektionen. Insgesamt 103 Proben hatten eine einzelne oder
mehrere HPV-Infektionen,
und 91,3 % (94/103) besaß lediglich
eine einzelne HPV-Infektion. Doppelte HPV-Infektionen traten in 8,7 % (9/103)
der Proben auf. Alle Proben wurden zuerst mit den Konsenus Gp5+/6+-PCR-Primern
getestet. Die HPV-PCR-negativen Proben von den Konsenus Gp5+/6+
wurden dann mit den β-Globin-Kontroll-Primern
zur Verifizierung von intakter DNA getestet. Die HPV-PCR-positiven
Proben wurden dieser DNA-Kontrolle nicht ausgesetzt. Die HPV-Negativ-Proben
in dieser Studie waren alle positiv mit den β-Globin-Kontroll-Primern. Lediglich
DNA-Proben, die bei einer Gp5+/6+-PCR positiv waren, wurden einer
HPV-artspezifischen
PCR ausgesetzt. HPV-Arten von Interesse waren HPV 16, 18, 31 und
33.
-
Echtzeit-Multiplex-NASBA:
Für die
Echtzeit-NASBA-Reaktionen wurden die Primer und Sonden von dem U1A-Genprodukt
als Leistungskontrolle für
intakte RNA verwendet. Proben, die negativ für U1A waren, wurden zurückgewiesen.
Insgesamt 14,2 % (110/773) der Proben waren positiv für wenigstens
einen der HPV-artspezifischen NASBA-Primer, einschließlich Proben,
die mehrere HPV-Infektionen zeigten. Von diesen Proben waren 54,5
% (60/110) positiv mit den HPV16-NASBA-Primern, 13,6 % (15/110)
mit den HPV18-Primern, 21,8 % (24/110) mit den HPV31-Primern und
13,6 % (15/110) mit den HPV33-Primern. Insgesamt 45 Proben waren
positiv mit den L1-Konsensus-Primern und im Allgemeinen zusammen
mit der HPV16-E6/E7-Onkogen-Expression 82,2 % (37/45). Der Konsensus
L1 wurde in 2,2 % (1/45) zusammen mit entweder HPV 18, 31 bzw. 33
nachgewiesen. L1 wurde auch alleine in 8,9 % (4/45) der Fälle nachgewiesen, und
sie alle waren PCR-positiv mit den Gp5+/6+-Primern. Insgesamt 108
Proben hatten eine einzelne oder mehrere HPV-Infektionen, und 98,1
% (106/108) hatten lediglich eine einzelne HPV-Infektion. Eine doppelte mRNA-Expression
trat in 1,9 % (2/108) der Proben auf.
-
Echtzeit-Multiplex-NASBA
im Vergleich zur PCR: insgesamt 87 Proben zeigten ein Vorliegen
von HPV16-DNA oder RNA bei der HPV16-PCR oder PreTect HPV-Proofer.
64,4 % (56/87) wurden positiv für
HPV 16 sowohl bei der PCR- als auch der Echtzeit-NASBA bestimmt.
39,1 % (34/87) waren lediglich bei der PCR positiv, und 3,4 % (3/87)
waren lediglich beim Echtzeit-NASBA
positiv. Bei HPV 18 zeigten insgesamt 20 Proben das Vorliegen von
HPV 18 DNA oder RNA entweder in der PCR- oder im Echtzeit-NASBA.
Von diesen 20 Proben waren 50 % (10/20) positiv bei beiden Tests,
und 35 % (7/20) waren lediglich positiv bei der PCR, und 15 % (3/20)
waren lediglich positiv beim Echtzeit-NASBA. Insgesamt 27 Proben
zeigten das Vorliegen von HPV 31 DNA oder RNA entweder in der PCR-
oder Echtzeit-NASBA. Von diesen 27 Proben waren 59,3 % (16/27) positiv
bei beiden Tests, und 11,1 % (3/27) waren positiv lediglich beim
PCR-Test, und 18,5 % (5/27) waren lediglich positiv beim Echtzeit-NASBA-Test.
Bei HPV 33 zeigten insgesamt 18 Proben das Vorliegen von HPV DNA
oder RNA entweder bei PCR- oder PreTect-HPV-Proofern, und 55,6 %
(10/18) der Proben waren bei beiden Tests positiv getestet worden.
16,7 % (3/18) waren lediglich positiv bei der PCR, und 22,2 % (4/18) waren
lediglich positiv beim Echtzeit-NASBA.
-
Tabelle
11: Statistische Verteilung von HPV in Proben bei PCR und Echtzeit-NASBA
-
Tabelle
12: Vergleich zwischen PCR und Echtzeit-NASBA
-
Tabelle
13: Echtzeit-NASBA-Ergebnisse für
L1
-
Tabelle
14: Genetische Spezifität
von Echtzeit-Multiplex-NASBA im Vergleich zu PCR
-
Tablle
14a: DNA-Sequenzierung von Gp5+-PCR-Primern (nicht in dem Artikel
eingeschlossen)
-
Diskussion
-
Die
Empfindlichkeit des Echtzeit-NASBA war im Allgemeinen besser als
die Empfindlichkeit der PCR. Die allgemeine Empfindlichkeit von
Echtzeit-NASBA für
alle Marker betrug zwischen 1 und 102 Zellen,
was um Einiges besser ist als für
die PCR-Reaktion mit einem Empfindlichkeitsbereich von 102 bis 104. Wie erwartet, war
die Empfindlichkeit der spezifischen Primer und Sonden besser als
die Empfindlichkeit der universellen Primer und Sonden. Echtzeit-NASBA
war genau so sensitiv oder sensitiver als ein Echtzeit-Multiplex-NASBA.
-
Echzeit-NASBA-Primer
und die molekulare Signalsonde, die gegen U1A gerichtet war (ein
menschliches Haushaltsgen), wurden als Leistungskontrolle für das Probenmaterial
in der Echtzeit-NASBA-Reaktion verwendet, um sicherzustellen, dass
die in dem Probenmaterial vorhandene RNA intakt war. Ein positives
Signal von dieser Reaktion war notwendig zur Validierung der Echtzeit-NASBA-Reaktion.
-
Die
Empfindlichkeit des universellen Echtzeit-NASBA mit L1 (das Hauptkapsidprotein
von HPV) war viel besser als die universelle Gp5+/6+-PCR, ebenfalls
gerichtet gegen L1, mit einer Empfindlichkeit von 10 Zellen im Vergleich
zu 103 (102) CaSki-Zellen.
Diese zwei Primersätze
(PCR und NASBA) haben ihre Ziele in derselben Region des konservierten
L1-Gens von verschiedenen HPV-Arten. Die Unterschiede in der Empfindlichkeit
sind auf die Tatsache zurückzuführen, dass
es im Allgemeinen nur eine Kopie von jedem Gen pro Zelle gibt, während die
Kopienanzahl von mRNA mehrere Hundert sein kann. Die Echtzeit-NASBA-L1-Primer detektierten
keine SiHa- oder HeLa-Zellen wie die Gp5+/6+-PCR-Primer, was auf
eine fehlende L1-Expression in diesen Zelllinien hinweist. Gp5+/6+-PCR-Primer
führten
zum Nachweis von 104 SiHa- oder HeLa-Zellen.
Unter Berücksichtigung
der Anzahl von HPV-Kopien in jeder Zelle macht es Sinn, dass die
CaSki-Zellen in 1/10 der Menge von SiHa- und Hela-Zellen nachgewiesen
wurden, da CaSki-Zellen 60-600 HPV-Kopien pro Zelle besitzen, sowohl
integriert als auch episomal, während
SiHa-Zellen 1-2 HPV-Kopien, integriert pro Zelle, und HeLa-Zellen
10-50 HPV-Kopien, integriert pro Zelle, besitzen. Der L1-Primersatz
detektierte lediglich CaSki-Zellen, sowohl mit integrierter als
auch episomalen Formen von HPV, und detektierte keine SiHa- oder HeLa-Zellen
mit lediglich integrierten Formen von HPV. Dies könnte darauf
hinweisen, dass das L1-Gen lediglich in episomalen Stadien der HPV-Infektion
exprimiert wird, und daher kann L1 ein wertbarer Marker zur Integration
und Beständigkeit
einer HPV-Infektion sein.
-
Die
HPV-artspezifischen NASBA-Primer sind gegen das E6/E7-Transkript
Bd.ler Länge
gerichtet, welches in großen
Mengen in Krebszellen aufgrund des fehlenden E2-Gen-Produkts exprimiert
wird. Die Echtzeit-NASBA-16-artspezifischen Primer führten zum
Nachweis von 10(1) SiHa-Zellen und 10(1) CaSki-Zellen im Vergleich
zu den HPV 16 PCR-Primern, welche 103(102) SiHa-Zellen detektierten. Die Erklärung hierfür könnte die
unterschiedliche Menge von HPV-Kopien
in jeder Zelllinie sein. Die CaSki-Zellen hatten sowohl integrierte
als auch episomale Formen von HPV, während die SiHa-Zellen lediglich
integrierte Formen von HPV besaßen.
Dies kann auf eine hohe Expression von mRNA von den E6/E7-Genen
zurückzuführen sein.
Bei der Detektion von CaSki-Zellen war das Detektionslimit für die NASBA-HPV16-Primer
10(1) CaSki-Zellen
im Vergleich zu 0,1 CaSki-Zellen für die HPV-16-PCR-Primer. Dies
ist wenig, aber eine Erklärung
könnte
sein, dass die CaSki-Zellen 60-600 Kopien HPV16-DNA enthalten, so
dass es möglich
ist, 0,1 CaSki-Zellen mit 6-60 HPV16-DNA-Kopien nachzuweisen. Die
niedrige Empfindlichkeit des Echtzeit-NASBA im Vergleich zur PCR kann
darauf hinweisen, dass die Expression von E6/E7 in den CaSki-Zellen
moderat/niedrig ist. Der Abbau nicht stabiler mRNA kann auch eine
Erklärung
sein. Die Menge von HPV-Kopien in den CaSki-Zellen bewegt sich in
der Größenordnung
des 60-600-fachen der SiHa-Zellen, was durch die empfindlichere
Detektion von CaSki-Zellen gezeigt wird.
-
Die
artspezifischen HPV18-PCR-Primer führten zum Nachweis von 102-HeLa-Zellen. Dies ist eine Größenordnung
von 100 besser als der HPV-Konsensus-Gp5+/6+-Primer und zeigt, dass
spezifische Primer im Allgemeinen empfindlicher sind als Konsensus-Primer.
Die Empfindlichkeit der artspezifischen HPV18-NASBA-Primer betrug
1 (0,1) HeLa-Zellen, was auf eine hohe Expression von E6/E7 in HeLa-Zellen hinweist.
-
Die
Empfindlichkeit von U1A-NASBA-Primern betrug 10 SiHa- oder CaSki-Zellen.
Das Ziel für
den U1A-Primersatz ist ein humanes Haushaltsgen, das in jeder menschlichen
Zelle exprimiert wird.
-
Die
Empfindlichkeit von PCR und NASBA variiert für unterschiedliche Primersätze und
Probenmaterial, und im Allgemeinen sind artspezifische Primer empfindlicher
als Konsensus-Primer
aufgrund des Basenpaarmismatches in den Konsensus-Primersätzen. Die
Anlagerungstemperatur für
die Primer in der PCR-Reaktion kann optimiert werden, was eine optimale
Reaktionsbedingung für
die Primer bereitstellt. Im Gegensatz zu der Anlagerungstemperatur
in der PCR muss die Anlagerungstemperatur für die NASBA-Primer auf 41 ° C gesetzt
werden. Diese fehlende Temperaturflexibilität kann die NASBA-Primer weniger
empfindlich und spezifisch als die PCR-Primer machen.
-
Die
PCR amplifiziert doppelsträngige
DNA, und das Ziel ist im Allgemeinen als eine Kopie pro Zelle vorhanden,
und dies macht es für
die Anzahl von Zellen in dem Probenmaterial auswertbar. Das Ziel
für die NASBA-Reaktion
ist RNA, und mRNA kann in mehreren Kopien pro Zelle vorliegen, was
von der Expression der Gene abhängt.
Durch die Wahl eines hoch exprimierten Gens kann die Anzahl der
mRNA-Kopien mehrere Hundert pro Zelle betragen und kann daher einfacher
nachzuweisen sein.
-
dsDNA
ist in der Zelle relativ stabil, und das Material bleibt für eine längere Zeit
intakt. Im Gegensatz zu dsDNA ist mRNA im Allgemeinen nicht sehr
stabil, und der Abbau von mRNA erfolgt schnell, was von der Zelle
abhängt.
Es gibt keine detektierbare DNase- oder RNase-Aktivität im Lysepuffer, so dass sowohl
dsDNA als auch ssRNA stabil sein sollten. Eine autokatalytische
Aktivität
kann sowohl DNA als auch RNA abbauen. Die DNA/RNA von der Zervixprobe
sollte für
24 Stunden bei 15-30°,
7 Tage bei 2-8° C
oder bei –70° C für eine Langzeitlagerung
bei Lagerung im Lysepuffer intakt bleiben.
-
Eine
Beschränkung
bei der Echtzeit-NASBA-Reaktion ist die Konzentration der molekularen
Signalsonden. Die Menge von Produkten wird die Konstellation der
molekularen Sigaalsonden übersteigen,
und daher wird sie nicht nachgewiesen werden, da eine hohe molekulare
Signalsondenkonzentration das Reaktionsgemisch komplexer machen
und die Amplifikationsreaktion inhibieren wird. Nukleotide können auch
eine Beschränkung
zu der Endmenge des Amplifikationsproduktes darstellen, sowohl bei
der PCR als auch in der NASBA-Reaktion.
Die Endkonzentration des amplifizierten Produktes kann selbst eine
weitere Amplifikation aufgrund der Menge des Produktes und der Komplexität des Reaktionsgemisches
inhibieren. Während
einer NASBA-Reaktion beim Vorliegen von molekularen Signalen könnte die
Sonde mit der Amplifikation durch Hybridisierung an die Matrize
konkurrieren, was sie für
die nachfolgende RNA-Synthese unverfügbar macht. In diesem Fall
wird RNA für
die reversen Transkriptionsschritte als Substrat extrahiert sowie
für die
weitere RNA-Synthese durch T7-RNA-Polymerase.
Diese Kompetition ist bei niedrigen Mengen des molekularen Signals
nicht signifikant und bei einer großen Menge des molekularen Signals
kann diese Inhibition durch eine hohe Anzahl von Kopien der Input-RNA überwunden
werden.
-
Die
lineare Beziehung zwischen der Menge von Input-RNA und der Zeit
für das
Positiv-Signal wurde in
10-fach-Serienverdünnungen
von unterschiedlicher HPV-Zelllinien getestet. Es gab einen klaren
Hinweis, dass ein positives Signal von der Menge von Input-RNA und
der Zeit abhängig
war. Die Multiplex-Reaktion erforderte mehr Zeit als eine Einzelreaktion,
um ein positives Signal hervorzurufen. Dies könnte auf die Kompetition in
dem komplexeren Gemisch in dem Multiplex-Reaktionsgefäß zurückzuführen sein
und auch auf die Tatsache, dass die Multiplex-Reaktion eine unterschiedliche
und niedrigere Konzentration von Primer und Sonde besitzt. Die Beziehung
zwischen Menge und Ziel-RNA und der Zeit für ein positives Signal öffnet sich
für eine
quantitative Echtzeit-Multiplex-Amplifikationsreaktion mit internen
RNA-Standards in
jedem Reaktionsgefäß.
-
Echtzeit-NASBA:
Einzel vs. Multiplex. Ein Echtzeit-NASBA war im Allgemeinen empfindlicher
als ein Echtzeit-Multiplex-NASBA. Dies ist wie erwartet, da eine
Kompetition zwischen Primern und Sonden in der Multiplex-Reaktion
stattfindet. Die Endkonstellation von Primern und molekularen Signalsonden
wurde in der Multiplex-Reaktion optimiert, so dass für wenigstens
einen der Primer- und Sondensätze
die Konzentration geringer war als in der Einzelreaktion. Daraus
folgt, dass bei einer niedrigeren Konzentration von Primern die
Reaktion weniger empfindlich ist oder die Reaktion wenigsten weniger
schnell abläuft.
Es nimmt eine längere
Zeit in Anspruch, um das exponentielle Stadium der Amplifikationsreaktion
zu erreichen und daher eine längere Zeit,
um die Produkte nachzuweisen. Die Konzentration der Primer stellt
keine Limitierung für
die Endkonzentration des Produktes in der NASBA-Reaktion dar, da
die von den Primern erzeugte doppelsträngige DNA weiter als Matrize
für die
RNA-Polymerase immer wieder in einer Schleife dient. Die Empfindlichkeit
des Multiplex-Echtzeit-NASBA war dieselbe für HPV 16 und HPV 18 im Vergleich
zu einem einzelnen Echtzeit-NASBA, jedoch sank die Empfindlichkeit
für L1
drastisch von einem Detektionslimit von 10(1) in der Einzelreaktion
auf 103(102) CaSki-Zellen
in der Multiplex-Reaktion ab. Bei U1A-NASBA-Primern sank die Empfindlichkeit
von 10(1) auf 102(10) SiHa-Zellen ab, während das
Detektionslimit für
die CaSki-Zellen gleich blieb. Diese Abnahme beim Detektionslimit
ist vermutlich auf eine komplexere Kompetition von Primern und molekularen
Signalsonden in der Multiplex-Reaktion zurückzuführen. Die Endkonzentration
von Primern und molekularen Signalsonden mag nicht die beste sein,
und die unterschiedlichen Primer und Signalsonden in der Multiplex-Reaktion können miteinander
interferieren. Die U1A-NASBA-Primer detektierten eine HeLa-Zelle.
Man könnte
dasselbe Detektionsniveau in allen Zelllinien erwarten, jedoch betrug
die Sensitivität
von HeLa-Zellen 1/10 des Detektionsniveaus von SiHa- und CaSki-Zellen.
Diese Zelllinien sind Krebszellen und könnten daher eine andere Wirkung
auf die Zellen haben, so dass die Expression von U1A anders ist.
Die Unterschiede können
auch auf die unterschiedlichen Zellmengen in jeder Reaktion zurückzuführen sein,
wegen der Zählfehler
während
der Ernte der Zellen.
-
Ein
Echtzeit-NASBA zeigte keine Kreuzreaktivität zwischen HPV 16, 18, 31 und
33 oder mit HPV 6/11, 35, 39, 45, 51, 52, 58 oder HPV X.
-
Die
Spezifität
der PCR-Reaktion kann besser sein als die Spezifität der Echtzeit-NASBA-Reaktion, da die
NASBA-Reaktion eine isothermale Reaktion bei 41 ° C ist ohne Möglichkeiten,
die Anlagerungstemperatur der Primer zu verändern. Die Primer sind grundsätzlich auf
dieselbe Weise entworfen wie die PCR-Primer. In einer PCR-Reaktion
hat man die Möglichkeit,
die Anlagerungstemperatur zu verändern,
anders als bei der NASBA-Reaktion, und daher kann man auch eine
Anlagerungstemperatur wählen,
die für
die beiden Primer optimal ist. Dies macht die Anlagerung der Primer
spezifischer. Die PCR-Ergebnisse wurden mit Gel-Elektrophorese visualisiert. Jedoch
sind die molekularen Signalsonden in der Echtzeit-NASBA-Reaktion ein zusätzlicher
Parameter im Vergleich zur PCR und können der Gesamt-NASBA-Reaktion eine bessere
Spezifität
verleihen. Es ist auch einfacher, zwei unterschiedliche Regionen
auf der DNA-Sequenz für
eine Primeranlagerung zu finden, da eine viel größere Flexibilität in der
Länge des
PCR-Produktes vorhanden ist als beim NASBA-Produkt, welches wenigstens
250 bp lang sein sollte. Es ist für die Spezifität der NASBA-Reaktion
wichtig, ein einzigartiges Gebiet auszuwählen, das zwischen den unterschiedlichen
HPV-Arten nicht konserviert ist. Ein Paar Basenfehlpaarungen kann
noch immer zu einer Amplifikation oder Hybridisierung des Ziels
führen.
-
Die
Detektion von CaSki-Zellen (im integrierten oder episomalen Stadium)
mit den universellen L1-NASBA-Primern, nicht jedoch von SiHa- oder
HeLa-Zellen (beide integriert), kann einen Hinweis geben, dass das
integrierte HPV keine L1-Expression zeigt, während HPV im episomalen Stadium
eine L1-Expression liefern kann.
-
Zusammengefasst
wurde ein Identifikations-Assay für die HPV-Arten 16, 18, 31
und 33 entwickelt, der die onkogene E6/E7-Expression dieser HPV-Arten
genau identifizieren lässt.
Der Assay kann auch die Expression des Hauptkapsidproteins, L1,
identifizieren.
-
Beispiel 3: Weitere klinische
Studien an 190 Patienten
-
Patienten/klinische Proben
-
Es
wurden Biopsien von 190 Frauen, bereitgestellt vom Ostfold Zentral
Krankenhaus, zur Behandlung von CIN im Zeitraum von 1999-2001 entnommen.
Das Durchschnittsalter der 190 Frauen in der Studie betrug 37,4
Jahre (Bereich von 22-74 Jahren). Die Biopsien waren bei –80° C unmittelbar
nach der Entnahme eingefroren.
-
Zytologische Untersuchung
der Proben
-
Es
wurden routinemäßige zytologische
Protokolle verwendet, um zytologische Befunde aufzuzeichnen. Es
wurden keine Versuche unternommen, die Objektträger erneut zu bewerten. Jeder
von ihnen wies auf einen CIN-II-III-Zustand hin, das heißt einer
hochgradigen Dysplasie oder HSIL, was die Basis für eine Krankenhausbehandlung,
Kolposkopie und Biopsie war.
-
Histologische Untersuchung
der Proben
-
Eine
Biopsie, hier als Biopsie 1 bezeichnet, wurde nach einem hochgradigen
Zytologie-Protokoll entnommen. Wenn es eine hochgradige Läsion bestätigt hat
(CIN-II oder -III), wurde der Patient wiederum ins Krankenhaus überwiesen,
dieses Mal für
eine Koloskopie-geführte
Konisation. Vor der Konisation, jedoch nach Anwendung einer lokalen
Anästhäsie, wurde
eine zweite Biopsie (Biopsie 2 von einem Gebiet entnommen, wo eine
Dysplasie am ehesten zu erwarten war, geschätzt anhand der Vorbefunde.
Diese Biopsie (2 × 2
mm) wurde innerhalb von 2 Min. in einer –80° C-Tiefkühltruhe eingefroren.
-
Die
Biopsie 2 wurde nach dem Einfrieren halbiert, und eine Hälfte wurde
für die
DNA/RNA-Extraktion verwendet. Die andere Hälfte wurde in 10 % gepuffertem
Formaldehyd fixiert und für
eine histopathologische Untersuchung weiterverarbeitet. Einige Läsionen waren
in dem Paraffinblock nicht richtig orientiert und mussten neu orientiert
oder seriell geschnitten werden, um das relevante Oberflächenepithel
zu zeigen. Daher kann nicht garantiert werden, dass genau dasselbe
Gewebe für
die Extraktion für
die histopathologische Bewertung verwendet wurde. Die Zapfenart
wurde letztendlich durch den örtlichen
Pathologen bewertet, der in allen Fällen das Vorliegen einer Dysplasie
bestätigen
konnte. Diese war nicht immer in demselben Grad wie in der ursprünglichen
Biopsie und in vielen Fällen
nicht die gleiche wie in Biopsie 2.
-
Extraktion
von Nukleinsäuren
-
Nukleinsäuren wurden
unter Verwendung des automatisierten Nuclisens-Extraktors wie zuvor
beschrieben isoliert (Boom et al., 1990). Jede Biopsie wurde in
zwei Hälften
geschnitten, eine war für
eine histologische Untersuchung bestimmt und die andere Hälfte für eine RNA-Analyse. Das für die RNA-Analyse
bestimmte Material wurde in kleinere Stücke aufgeteilt, während es
auf Trockeneis (–80° C) gehalten
wurde und in 1 ml Lysepuffer gegeben (wie oben), gefolgt von einer
20 Sek. langen Homogenisierung unter Verwendung von wegwerfbaren
Pestillen. 100 ml der Probe wurden weiter 10-fach in Lysepuffer
verdünnt
und 100 ml wurden dann für
DNA/RNA extrahiert. Die extrahierte DNA/RNA wurde mit ungefähr 40 ml
Elutionspuffer eluiert (Organon Teknika) und bei –70° C gelagert.
-
Alle
in dieser Studie verwendeten molekularen Signalsonden machten Gebrauch
von der Flurophore FAM (6-Carboxyfluoreszin) am 5'-Ende der Struktur.
Diese war an eine variable Stamm-Schleifen-Sequenz gebunden, die
an den universellen Quencher 4-(4'-Dimethylaminophenylazo)benzolsäure (DABCYL)
am 3'-Ende gekooppelt
war. Die Sonden wurden von Eurogentec, Belgien, geliefert. Die Endekonzentration
der in der Reaktion verwendeten MBs betrug 2,5 mM. Für den Echtzeit-NASBA
verwendeten wir den NucliSens Basic Kit (Organon Teknika, Niederlande),
der für
die Entwicklung von benutzerdefinierten RNA-Amplifikations-Assays bestimmt
ist. Die NASBA-Amplifikation wurde in einem Volumen von 20 μl durchgeführt. Die
Primer-Sätze
und -Sonden waren gegen E6/E7-mRNA voller Länge für die Hochrisiko-HPV 16, 18,
31 und 33 gerichtet. Als Leistungskontrolle sowie zur Vermeidung
von Falsch-Negativ-Ergebnissen aufgrund der Degradation von Nukleinsäure verwendeten
wir einen Primersatz und eine Sonde, die gegen das menschliche kleine
nukleare U1 Ribonukleinprotein (snRNP) spezifische A-Protein (U1A
mRNA) gerichtet war (Nelissen et al., 1991). Alle Proben wurden
zweifach auf getrennten Apparaten laufen gelassen (Mikroplatten-Lesegeräte zur Messung
der Fluoreszenz und Absorption, Bio-tek FL-600 FA von MWG). mRNA,
die von CaSki/SiHa- oder HeLa-Zellen isoliert war, diente als Positivkontrolle
für die
HPV 16- bzw. HPV 18-Transkripte. Negativkontrollen, die für jede siebte Reaktion
eingeschlossen waren, bestanden aus einer Reaktion, die alle Reagenzien
außer
mRNA enthielten.
-
HPV-DNA-Analyse; Polymerase-Kettenreaktion
-
Dieselben
Extrakte und Mengen wie in der NASBA-Reaktion wurden auch für die PCR
verwendet. Die L1-Konsensus-Prier GpS+/Gp6+ wurden verwendet, um
alle Proben zu detektieren, die HPV-DNA enthalten. Die PCR-Amplifikation
wurde wie oben beschrieben durchgeführt. Die erste DNA-Denaturierung
wurde für
2 Minuten bei 94° C
durchgeführt,
dann wurden 40 PCR-Zyklen laufen gelassen: Denaturierung für 1 Minute
bei 94° C,
Anlagerung für
2 Min. bei 40° C,
Verlängerung
für 1,5
Min. bei 72° C,
gefolgt von einer Schlussverlängerung
für 4 Min.
bei 72° C.
Die Einordnung von HPV wurde unter Verwendung von PCR-artspezifischen
Primern gegen HPV 16, 18, 31 und 33 durchgeführt, wie oben beschrieben (6/11,
35, 45, 51, 52, 58).
-
Ergebnisse
-
Von
ursprünglich
190 Patienten wurde eine Biopsie entnommen, nachdem eine Diagnose
für CIN
I, CIN II oder CIN III anhand der Zytologie gestellt wurde. Eine
hochgradige Läsion
wurde durch eine histologische Untersuchung bestätigt, 150 Proben wurden als
CIN III (78,9 %) diagnostiziert. Biopsie 2, entnommen vor der Konisation,
wurde für
eine RNA-Analyse verwendet. Jedoch führte eine histologische Untersuchung
dieser Biopsie zu einer Diagnose von lediglich 53 Proben der ursprünglich 150
Proben als CIN III (54 ergaben keine Diagnose, 24 wurden als CIN
II diagnostiziert, 18 als CIN I und 4 als HPV/Kondylom). Die Anzahl
von CIN II-Proben
nahm von 16 (8,4 %) auf 30 (15,8 %) zu (durch Histologie I, 24 diagnostiziert
als CIN III, 4 als CIN II, 1 als Karzinom und 1 als CIN I. 12 CIN
II-Fällen
der Histologie I wurde eine niedrigere Diagnose in Histologie II
gegeben). Der Grad von CIN I nahm von 6 Proben (3,2 %) auf 32 Proben
(16,8 %) zu. Die 2 Plattenepithelzellkarzinome wurden in der Histologie
II als CIN III diagnostiziert, das Adenokarzinom als CIN II. In
71 Proben (38,4 %) wurden keine hochgradigen Läsionen nachgewiesen.
-
Onkogene
HPV-RNA wurde in 69 (36 %) der 190 Patienten nachgewiesen. Von den
53 Proben (28 %), die als CIN III in der Histologie II diagnostiziert
waren, hatten wir 40 (76 %) der Fälle, die eine HPV 16, 18, 31 oder
33 onkogene Expression zeigten. Zusätzlich fanden wir eine onkogene
Expression in 9 von 30 Fällen
(30 %) von CIN II, in 4 von 32 Fällen
(13 %) von CIN I, 14 von 71 Fällen
(20 %) zeigten keine Zellabnormalitäten, und in 2 von 4 (50 %)
der Proben wurde HPV/Kondylom diagnostiziert.
-
HPV
16 RNA wurde in 42 der 190 Patienten gefunden, HPV 18 wurde in 7
(3,7 %), HPV 31 in 15 (7,9 %) und HPV 33 in 8 (4,2 %) gefunden.
Ein Patient hatte eine gemischte Infektion mit HPV 16 und HPV 18
und einer mit HPV 16 und HPV 31.
-
Unter
Verwendung der Konsenus-GpS+/Gp6+-Primer, die gegen das L1-Gen gerichtet
waren, welches das Hauptkapsidprotein kodiert, führte eine PCR zum Nachweis
von HPV in 81 der 190 Zervixbiopsien (43 %). Von diesen 119 Fällen, denen
eine Diagnose in der zweiten histologischen Untersuchung gegeben wurde
(115 wurden als CIN, 4 als HPV/Kondylom diagnostiziert), wurde bei
63 festgestellt, dass sie HPV-DNA enthalten. Die zusätzlichen
18 nachgewiesenen Fälle
ergaben keine histologische Diagnose. 20 der 81 Fälle waren
nicht durch den NASBA detektierbar; 7 von diesen ergaben eine Diagnose
von CIN III, 2 wurden als CIN II diagnostiziert, 4 als CIN I, und
7 ergaben keine Diagnose.
-
Eine
artspezifische PCR detektierte 85 Fälle, die HPV enthalten, 66
mit HPV 16, 10 mit HPV 18, 14 mit HPV 31, 7 mit HPV 33. 12 Fälle hatten
eine Mehrfach-Infektion: 3 mit HPV 16+18; 4 mit HPV 16+33, 5 mit HPV
16+31. 20 hatten keine Diagnose.
-
Beispiel 4
-
HPV,
detektiert durch PreTect HPV-Proofer und PCR im Vergleich zur Zytologie
und Histologie:
Normale und ASCUS-Proben (einschließlich Grenzabstriche)
wurden durch Zytologie bestimmt. Alle Proben wurden mit Konsensus-PCR
und PreTect HPV-Proofern getestet, jedoch wurden nur die Konsensus-positiven Proben
durch PCR typisiert. Die CIN 3- und Krebs-Proben wurden durch Histologie
bestimmt, und alle Proben wurden mit sämtlichen drei Verfahren getestet.
Die Ergebnisse sind in 6 gezeigt. Eine Übereinstimmung zwischen
Echtzeit-Multiplex-NASBA
und PCR im Vergleich zur Zytologie oder Histologie ist in Tabelle
15 unten gezeigt.
-
Tabelle
15: Übereinstimmung
zwischen Echtzeit-Multiplex-NASBA und PCR im Vergleich zur Zytologie
oder Histologie
-
Es
wurden nur Proben, die positiv durch Gp5+/6+ PCR waren, typisiert.
- a einschließlich PCR und Echtzeit-Multiplex-NASBA-positive
und -negative Proben.
- b einschließlich PCR und/oder Echtzeit-Multiplex-NASBA-positive
Proben.
- c ASCUS ohne Grenzbereichsabstriche.
-
Beispiel 5
-
Ein
Kit zum Nachweis von mRNA-Transkripten von dem E6-Gen(en) von HPV
wird bereitgestellt, wobei der Kit ein oder mehrere, zwei oder mehrere
und vorzugsweise alle folgenden Primer-Paare und nachfolgende Identifikationssonden
umfasst.
-
-
-
Als
Alternative zu den oben gezeigten Sonden kann der Kit gegebenenfalls
eine oder mehrere der folgenden molekularen Signalsonden einschließen: Molekulare
Signalsonden:
| H16e6702mb2-FAM | ccagctTATGACTTTGCTTTTCGGGAagctgg |
| H18e6702mb1-TxR | cgcatgGAACCAACGTCACACAATGcatgcg |
| H31e6704mb2-FAM | ccgtcgGGACAAGCAGAACCGGACAGATCCAAcgacgg |
| H33e6703mb1-FAM | ccaagcGGACAAGCACAACCAGCCACAGCgcttgg |
-
Vorzugsweise
schließt
der Kit auch das folgende Primer-Paar und folgende Sonde ein:
-
Die
HPV 45 Sonde oben kann durch eine molekulare HPV-Signalsonde wie
folgt ersetzt werden:
-
Zusätzlich kann
der Kit ein oder mehrere der folgenden Primer-Paare und nachfolgende
Identifikationssonden einschließen,
was von dem geographischen Anwendungsgebiet des Kits abhängt.
-
-
-
Die
oben gezeigten Sonden können
in dem Kit durch die folgenden molekularen Signalsonden ersetzt werden:
Sequenzprotokoll