-
Gebiet der Erfindung
-
Die
vorliegende Erfindung bezieht sich allgemein auf Abdichtungsmittel
für poröse implantierbare
Einrichtungen. Die vorliegende Erfindung bezieht sich insbesondere
auf poröse
implantierbare künstliche
Gefäße (Gefäßtransplantate),
die mit Hydrogelen oder Sol-Gel-Mischungen von Polysacchariden imprägniert sind, welche
die Transplantate blutdicht machen. Gemäß einem anderen Aspekt betrifft
die vorliegende Erfindung die zeitverzögerte Freisetzung von therapeutischen
Agentien, mit denen die inneren Hohlräume dieser Transplantate imprägniert sind.
Die Erfindung betrifft außerdem
Verfahren zur Herstellung dieser Transplantate.
-
Hintergrund
der Erfindung
-
Im
Allgemeinen ist es wichtig, dass implantierbare schlauchförmige Einrichtungen,
die dazu bestimmt sind, Flüssigkeiten
aufzunehmen, flüssigkeitsdicht
und nichtthrombogen sind und gleichzeitig das Hineinwachsen von
Gewebe fördern.
Dies gilt insbesondere für
implantierbare künstliche
Gefäße (Gefäßprothesen).
Um das Hineinwachsen von Gewebe zu ermöglichen, muss eine solche Prothese
porös sein.
Die meisten textilen porösen
Endoprothesen und Transplantate sind jedoch nicht von Natur aus
blutdicht und wenn sie nicht vorher abgedichtet oder beschichtet
werden mit einem biologisch verträglichen wasserdichten Überzug,
kann durch die Wände
des Transplantats hindurch eine beträchtliche Blutung auftreten.
Daher muss ein Gleichgewicht aufrechterhalten werden zwischen der
Aufrechterhaltung einer blutdichten Oberfläche und der Förderung
des Hineinwachsens von Gewebe in solche Gefäßprothesen. Insbesondere müssen Gefäßtransplantate,
die aus porösen
Materialien hergestellt sind, während
der anfänglichen
Einführung
des Gefäßtransplantats
in den Körper
eines Patienten blutdicht sein, um Blutverluste in dem Patienten
zu vermindern. Wenn jedoch das Transplantat an Ort und Stelle einheilt,
muss das Hineinwachsen eines Gewebes in das Transplantat gefördert werden.
Es ist daher wünschenswert,
dass Transplantatmaterialien sowohl blutdicht sind als auch das
Hineinwachsen von Gewebe fördern.
Diese Eigenschaften machen es jedoch erforderlich, dass das Transplantat zwei
unterschiedliche physikalische Strukturen aufweist.
-
So
müssen
beispielsweise Gefäßtransplantat-Materialien,
die das Hineinwachsen von Gewebe und das Einheilen fördern, porös genug
sein, um das Einwandern von Zellen und Nährstoffen in das Transplantat zu
ermöglichen.
Ein solches Hineinwachsen von Zellen ist wichtig für die Langzeit-Offenheit
bzw. -Durchgängigkeit
des Transplantats. Nylon, Polyester, Polytetrafluorethylen (PTFE),
Polypropylen, Polyurethan, Polyacrylnitril und dgl. sind aus dem
Stand der Technik bekannt als Materialien für die Herstellung solcher Gefäßtransplantate.
PTFE und Polyester werden heutzutage in großem Umfange angewendet, weil
sie inerte Materialien sind, die eine niedrige Thrombogenizität im Körper aufweisen.
Insbesondere Polyethylenterephthalat wird am häufigsten zur Herstellung von
textilen Gefäßtransplantaten
und Endoprosthesen verwendet.
-
Für den Chirurgen
ist die Porosität
dieser Transplantatmaterialien ein wesentlicher Faktor, der zu berücksichtigen
ist. Insbesondere trägt
die Porosität
dieser Materialien zur Langzeit-Durchgängigkeit und zur Gesamtleistungsfähigkeit
eines Transplantats bei. Außerdem
nimmt die Leichtigkeit der Handhabung, die Anastomose und die Flexibilität in der
Regel zu, wenn die Porosität
eines Transplantatmaterials zunimmt. Auch der Heilungsprozess, d.h.
die Fähigkeit,
dass Gewebszellen in das Transplantat eindringen können, nimmt
zu, wenn die Porosität
des Transplantatmaterials zunimmt.
-
Die
Fähigkeit
dieser porösen
Transplantatmaterialien, das Einwachsen von Gewebe zu fördern und dgl.,
hat jedoch ihren Preis. Unbehandelt ist ein solches Transplantat
nicht blutdicht. Wenn somit das Transplantat implantiert wird, ist
das Bluten durch die Poren in der Oberfläche des Transplantats ein großes Problem. Es
wurden bereits andere Methoden entwickelt, um einen Blutverlust
durch die Leckage des Gefäß-Transplantats zu
verringern. Beispielsweise wurden weniger poröse Materialien als Gefäß-Transplantate
verwendet. Diese Materialien haben jedoch den Nachteil, dass sie
nicht in der Lage sind, die Endothelbildung in dem Lumen und das
Einwachsen von Gewebe in das Transplantat zu unterstützen. Daher
sind solche textilen Transplantatmaterialien nicht praktikabel,
weil ihre Offenheit bzw. Durchgängigkeit
von kurzer Dauer ist.
-
Alternativ
sind auch bereits poröse
Gefäßtransplantatmaterialien
mit Blut vorbehandelt worden, bevor das Transplantat in den Körper eingeführt wird.
Durch eine solche Vorbehandlung werden Abdichtungsfaktoren in das
gesamte Transplantat eingeführt,
welche die Verringerung des Blutens während des chirurgischen Eingriffs
dadurch verringern, dass sie bewirken, dass das Blut gerinnt, bevor
ein signifikanter Blutverlust bei dem Patienten auftritt. Im Allgemeinen
werden diese Transplantate in frisches Blut des Patienten eingetaucht
oder damit gespült,
um die Oberflächen
des Transplantats vorzubehandeln. Diese Methoden sind jedoch beschränkt, weil
sie zeitraubend sind, Bluttransfusionen des Patienten erfordern
und die Menge des Blutverlustes bei dem Patienten erhöhen. Diese
Methoden stehen daher nicht zur Verfügung im Falle von medizinischen Notfallsituationen,
bei denen der Patient bereits eine große Menge Blut verloren hat
oder bei denen die Zeit ein kritischer Faktor ist. Außerdem sind
diese Methoden möglicherweise
bei Patienten nicht wirksam, die Antikoagulantien, wie z.B. Heparin
oder Warfarin, einnehmen.
-
Es
wurde eine beträchtliche
Forschungsarbeit gewidmet der Entwicklung von Materialien, die anfänglich blutdicht
sind und dann allmählich
poröser
werden, um das Einheilen und das Einwachsen von Gewebe in die implantierte
Gefäßprothese
zu erleichtern. Ein Großteil
dieser Forschungsarbeiten hat sich konzentriert auf die Beschichtung
der Oberfläche
von porösen
Transplantatmaterialien mit extrazellulären Matrix (ECM)-Proteinen,
um diese Transplantatmaterialien blutdicht zu machen, die jedoch
mit dem Ablauf der Zeit biologisch abgebaut werden und das Einwachsen
von Gewebe in das Transplantat fördern.
So wurden beispielsweise Kollagen, Albumin, Gelatine, Elastin und
Fibrin als biologisch resorbierbare Abdichtungsmaterialien für poröse Gefäßprothesen
verwendet.
-
Außerdem sind
auch Gele, Hydrogele und Sol-Gele als biologisch verträgliche,
biologisch abbaubare Materialien beschrieben worden. Ein Gel ist
eine Substanz, die Eigenschaften aufweist, die zwischen denjenigen
einer Flüssigkeit
und denjenigen eines Feststoffes liegen. Gele verformen sich elastisch
und erholen sich wieder, bei höheren
Belastungen tritt jedoch häufig
ein Fließen
auf. Sie weisen ausgedehnte dreidimensionale Netzwerkstrukturen
auf und sind hoch porös.
Daher enthalten viele Gele einen sehr hohen Anteil von Flüssigkeit,
bezogen auf den Feststoff. Die Netzwerkstrukturen können dauerhaft
oder vorübergehend
sein und basieren auf polymeren Molekülen, die im Prinzip aus einer
kolloidalen Lösung
beim Stehenlassen gebildet werden. Ein Hydrogel kann daher beschrieben
werden als ein Gel, dessen flüssiger
Bestandteil Wasser ist. Im Gegensatz dazu ist ein Sol eine kolloidale
Lösung,
d.h. eine Suspension von Feststoffteilchen mit kolloidalen Dimensionen
in einer Flüssigkeit
(vgl. "Larouse Directory
of Science and Technology" 470,
543 (1995)).
-
So
ist beispielsweise in dem US-Patent Nr. 5 209 776 (Bass et al.)
eine Zusammensetzung zum Verbinden von getrennten Geweben oder zum
Beschichten der Oberfläche
von Geweben oder Prothesematerialien zur Ausbildung einer wasserdichten
Abdichtung darauf beschrieben. Die Zusammensetzung dieses Patents
umfasst eine erste Protein-Komponente, bei der es sich vorzugsweise
um ein Kollagen handelt, und eine zweite, ein Protein tragende Komponente,
bei der es sich um ein Proteoglycan, ein Saccharid oder einen Polyalkohol
handeln kann. In dieser Zusammensetzung ist die zweite Komponente
geeignet, die erste Komponente zu tragen durch Bildung einer Matrix,
eines Sols oder eines Gels mit der ersten Komponente. Die gebildete
Matrix, das gebildete Sol oder das gebildete Gel ist somit eine
Hybrid-Zusammensetzung,
die eine Protein-Komponente und eine ein Protein tragende Komponente
umfasst, bei der es sich um ein Protein, ein Saccharid oder einen
Po lyalkohol handeln kann. Die Protein-Komponente übt die Einheilungs-
oder Bindungsfunktion aus, während
die ein Protein tragende Komponente eine Trägermatrix für das Protein bildet.
-
In
einem anderen Beispiel beschreiben die US-Patente Nr. 5 135 755
und 5 336 501 (beide Czech et al.) Hydrogele, die als Wundsekret-Absorber
verwendet werden können
oder in Wundverbände
eingearbeitet werden können,
um Wundsekrete zu absorbieren. Die Hydrogel-Zusammensetzung dieser
Erfindungen umfasst 20 bis 70 mindestens eines mehrwertigen Alkohols,
wie z.B. Glycerin, 10 bis 35 % mindestens eines natürlichen
Biopolymer-Verdickungsmittels, 0,05 bis 10 % eines Vernetzungsmittels
und 0 bis 50 % Wasser oder einer physiologischen Salzlösung.
-
Das
Gel oder Hydrogel, das in diesen Patenten beschrieben ist, kann
Gelatine allein oder Gelatine in Kombination mit einem Polysaccharid,
insbesondere einem Alginat, sein. Das Hydrogel dieser Patente ist
somit ein Proteinhydrogel oder ein Protein-Polysaccharid-Hybrid-Hydrogel. Außer Gelatine
sind Kollagene und Pectine ebenfalls bevorzugte Protein-Komponenten
in den Hydrogel-Materialien dieser Patente. Diese Patente erfordern
alle konventionelle Protein-Materialien zur Erzielung der Abdichtungsfunktion
und die Hydrogele werden als Träger
für die
Proteine verwendet.
-
Diese
Hybrid-Beschichtungszusammensetzungen, die in den Bass- und Czech-Patenten beschrieben sind,
sind jedoch nicht leicht herstellbar. Beispielsweise werden die
Protein-Komponenten der Hybrid-Beschichtungszusammensetzungen während der
Herstellung, der Sterilisation oder Lagerung des mit dem Hydrogel
beschichteten Materials denaturiert (ein Wundverband wie bei Czech
oder eine implantierbare Einrichtungen wie bei Bass). Wenn sie einmal
denaturiert sind, verlieren diese Hybrid-Beschichtungszusammensetzungen
ihre Fähigkeit,
wirksam zu sein. Ein anderes Problem, das bei solchen Hybrid-Beschichtungszusammensetzungen
auftritt, besteht darin, dass die Oberfläche des Substratmaterials,
z.B. des Wundverbandes oder der implantierbaren Einrichtung, vorbehandelt
werden muss mit beispielsweise Plasma, um diese Zusammensetzungen
wirksam an die Oberfläche
beispielsweise eines Gefäß-Transplantats,
zu binden. Außerdem werden
diese Hybrid-Zusammen setzungen als Überzüge auf der Oberfläche eines
Substratmaterials abgeschieden. Solche Oberflächenbeschichtungen sind darauf
beschränkt,
dass sie leicht zugänglich
sind für
abbauende Enzyme des Körpers
und dass sie somit schnell abgebaut werden.
-
In
dem Bestreben, die Probleme zu mildern, die bei solchen Protein-
oder Protein-Hybrid-Überzügen auftreten,
wird in dem US-Patent 5 415 619 (Lee et al.) ein Verfahren beschrieben,
mit dem ein poröses
Gefäß-Transplantat
blutdicht gemacht wird durch Imprägnieren seiner Oberfläche mit
einem Polysaccharid oder einem Polysaccharid-Derivat. Daher wird
in dem US-Patent Nr. 5 415 619 der Ausdruck "imprägnieren" verwendet, der für eine physikalische
Adsorption oder eine chemische Bindung der Polysaccharide an die
Oberfläche
eines Transplantats steht. Obwohl durch dieses Verfahren die das
Problem der Proteindenaturierung während der Herstellung, Sterilisation
und Lagerung beispielsweise einer Gefäß-Prothese gemildert wird, muss
die Oberfläche
eines solchen Transplantats chemisch oder physikalisch verändert werden,
um den Polysaccharid-Überzug
an seine Oberfläche
zu binden. So wird beispielsweise in dem US-Patent Nr. 5 415 619 die
chemische Oxidation der Oberfläche
eines porösen
Gefäßtransplantats
mit einer Schwefelsäure-
oder Perchlorsäure-Lösung vor
dem Imprägnieren
der Oberfläche
des Transplantats mit einer Polysaccharid-Lösung, beschrieben. Alternativ
wird in diesem Patent die physikalische Veränderung der Oberfläche eines
solchen Transplantats durch Vorbehandlung mit Plasma oder mit einer
Coronaentladung beschrieben. In jedem Fall werden in dem US-Patent
Nr. 5 415 619 zusätzliche
unnötige
Stufen zu einem solchen Verfahren hinzugefügt durch chemische oder physikalische
Vorbehandlung der Oberfläche
dieser Gefäßtransplantate.
-
In
EP-A-0 203 635 ist eine Gefäßprothese
beschrieben, die einen PTFE-Schlauch umfasst. In Beispiel 8 von
EP-A-0 230 635 ist die Herstellung einer Lösung von Heparin und Chitosan
zum Aufbringen auf die innere Oberfläche der Schlauchwand beschrieben.
-
Es
wäre daher
wünschenswert, über ein
verbessertes biologisch resorbierbares Abdichtungsmittel für poröse implantierbare
Prothesen, wie z.B. Gefäßprothesen
(Gefäßtransplantate),
zu verfügen,
das die poröse Prothese
beim Einführen
in den Körper
blutdicht macht und das mit dem Ablauf der Zeit biologisch resorbierbar ist,
sodass das Einwachsen von Gewebe gefördert wird. Insbesondere wäre es wünschenswert, über ein
verbessertes biologisch resorbierbares Abdichtungsmittel für ein poröses Gefäßtransplantat
zu verfügen,
das ein solches Transplantat blutdicht macht und das keine physikalische
oder chemische Modifizierung der Oberfläche eines solches Transplantats
vor der Einarbeitung des Abdichtungsmittels erfordert.
-
Zusammenfassung
der Erfindung
-
Gegenstand
der vorliegenden Erfindung ist eine verbesserte, biologisch resorbierbare
Abdichtungsmittel-Zusammensetzung für implantierbare Prothesen.
Die biologisch resorbierbare Abdichtungsmittel-Zusammensetzung umfasst
insbesondere eine Kombination aus mindestens zwei Polysacchariden,
die ein Hydrogel bilden, das den implantierbaren Prothesen eine
im Wesentlichen blutdichte Sperrschicht verleiht. Vorzugsweise ist
die Prothese eine Weichteil-Prothese, die in dem Gefäßsystem
verwendet wird, beispielsweise ein Gefäßtransplantat oder eine Endoprothese.
Die Erfindung betrifft auch andere schlauchförmige Prothesen oder Weichteil-Prothesen,
wie z.B. ein chirurgisches Netz oder Hernien-Verschlüsse. Die
implantierbare Prothese wird vorzugsweise hergestellt aus einem
synthetischen Textilmaterial, das zu einer schlauchförmigen Prothese
gewoben oder gewirkt ist. Zu geeigneten Materialien gehören beispielsweise
unter anderem Polyester, Poly(tetrafluorethylen), Nylon, Polypropylen,
Polyurethan und Polyacrylnitril. Zusätzlich zu gewirkten oder gewobenen
Textilgeweben kann die Prothese hergestellt werden unter Anwendung
von Extrusions- und Expansionsverfahren, z.B. mit geschäumtem Poly(tetrafluorethylen)
(ePFTE). Die vorliegende Erfindung betrifft auch Verbundwerkstoffe
aus diesen Materialien und andere.
-
Zu
erfindungsgemäß verwendbaren
Polysacchariden gehören
Algin, Carboxymethylcellulose, Carrageenan, beispielsweise Carrageenan
vom Typ I, Carrageenan vom Typ II, Carrageenan vom Typ III und Carrageenan
vom Typ IV, Furcellaran, Agarose, Guargummi, Johannisbrotgummi,
Gummiarabicum, Hydroxyethylcellulose, Hydroxypropylcellulose, Methylcellulose,
Hydroxyalkylmethylcellulose, Pectin, teilweise deacetyliertes Chitosan,
Stärke
und Stärke-Derivate,
wie z.B. Amylose und Amylopectin, Xanthan, Hyaluronsäure und ihre
Derivate, Heparin, ihre Salze und Mischungen davon.
-
Wie
vorstehend angegeben, ist erfindungsgemäß eine Kombination aus mindestens
zwei Polysacchariden oder aus einem Polysaccharid und einem Protein
erforderlich zur Bildung eines Hydrogels. Erfindungsgemäß können zahlreiche
Kombinationen von Polysacchariden verwendet werden, wie z.B. Alginsäure/Pectin, Alginsäure/Chitosan,
Carrageenan vom Typ I/Johannisbrotgummi, Carrageenan vom Typ I/Pectin,
Carrageenan vom Typ II/Johannisbrotgummi, Carrageenan vom Typ II/Pectin,
Carrageenan vom Typ II/Guargummi, Carrageenan vom Typ IV/Johannisbrotgummi,
Johannisbrotgummi/Xanthangummi, Guargummi/Johannisbrotgummi, Guargummi/Xanthangummi
und Agar/Guargummi. Zu bevorzugten Kombinationen von Polysacchariden,
die ein Hydrogel bilden, gehören
Carrageenan vom Typ II mit einem Ca+2 Ion
und/oder Johannisbrotgummi oder Carrageenan vom Typ IV und Ca+2 mit oder ohne Johannisbrotgummi. Zu anderen
bevorzugten Kombinationen gehören
gereinigte Agarose/Guargummi sowie Chitosan/Guargummi. Weil ständig neue
Polysaccharide isoliert und charakterisiert werden und neue Polysaccharide
nach molekularbiologischen Verfahren hergestellt werden können, sind
erfindungsgemäß auch andere
derartige Polysaccharide verwendbar.
-
Die
vorliegende Erfindung betrifft außerdem die Einarbeitung eines
therapeutischen oder biologisch aktiven Agens in das Hydrogel. Auf
diese Weise setzt das Hydrogel auf kontrollierbare Weise das therapeutische
Agens frei, während
das Hydrogel biologisch abgebaut oder biologisch resorbiert wird.
Eine besonders vorteilhafte Klasse von therapeutischen Agentien
sind die Antikoagulantien. Der hier verwendete Ausdruck "Antikoagulans" kann umfassen jedes
Agens, das für
solche Zwecke geeignet ist. Zu den derzeit als nützlich bekannten Agentien gehören Heparin,
sulfatierte Polysaccharide, Prostaglandin, Urokinase, Hirudin, Streptokinase,
ihre pharmazeutischen Salze und Mischungen davon. Heparin ist bevorzugt,
weil es sich um ein Polysaccharid handelt und einem Gel leicht einverleibt
werden kann. Außerdem
sind Kombinationen von Heparin/Chitosan auch bekannt dafür, dass
sie in Kombination Gele bilden, wie in der Tabelle 2 angegeben.
-
Erfindungsgemäß kann das
aus Kombinationen von Polysacchariden hergestellte Hydrogel vernetzt werden
zur Bildung einer dichteren Sperrschicht und einer umlaufenden Versiegelung,
beispielsweise innerhalb der interstitiellen Räume der porösen Einrichtung.
-
Gemäß einer
anderen Ausführungsform
betrifft die vorliegende Erfindung ein Material mit kontrollierter Freisetzung,
das umfasst eine Hydrogelmatrix, die aus mindestens zwei Polysacchariden
und einem in die Matrix eingearbeiteten Antikoagulationsmittel hergestellt
ist. Der interstitielle Raum zwischen den inneren und äußeren Oberflächen einer
porösen
implantierbaren Einrichtung wird mit diesem Material imprägniert.
-
Gemäß einer
weiteren Ausführungsform
betrifft die vorliegende Erfindung ein Abdichtungsmittel für ein implantierbares
poröses
Luminal-Substrat. Bei dieser Ausführungsform der Erfindung wird
ein poröses
Substrat mit einer inneren und einer äußeren Oberfläche mit
dazwischen definierten interstitiellen Räumen bereitgestellt. Das Abdichtungsmittel
dieser Ausführungsform
umfasst ein Hydrogel, das in Kombination mindestens zwei Polysaccharide
enthält.
Dieses Abdichtungsmittel füllt
den interstitiellen Raum des porösen
Substrats und bildet eine im Wesentlichen flüssigkeitsdichte Sperrschicht
zwischen den inneren und äußeren Oberflächen des
porösen
Materials. Das Abdichtungsmittel kann auch ein Sol-Gel sein, das
mindestens zwei Polysaccharide in Kombination enthält.
-
Bei
einer anderen Ausführungsform
der vorliegenden Erfindung umfasst die Prothese ein schlauchförmiges Element,
das mit einem Hydrogel imprägniert
ist, das definiert ist durch eine Mischung aus einem Samengummi-Polysaccharid
und einem Seetangextrakt-Polysaccharid, dispergiert in einer Glycerin-Wasser-Lösung. Alternativ
umfasst diese Prothese ein schlauchförmiges Element, das mit einem
Hydrogel im prägniert ist,
das definiert ist durch eine Mischung aus einer linearen Polysaccharid-Komponente und einer
verzweigten Polysaccharid-Komponente, dispergiert in einer Glycerin-Wasser-Lösung.
-
Gegenstand
der Erfindung ist außerdem
ein Verfahren, um ein implantierbares poröses schlauchförmiges Substrat
flüssigkeitsdicht
zu machen. Das Verfahren umfasst die Bereitstellung eines implantierbaren porösen Substrats,
das eine innere und eine äußere Oberfläche mit
einem dazwischen definierten interstitiellen Raum umfasst; die Bereitstellung
eines Hydrogels oder Sol-Gels, das mindestens zwei Polysaccharide
enthält;
und die Imprägnierung
des porösen
Substrats mit dem Hydrogel oder mit dem Sol-Gel, um das Substrat flüssigkeitsdicht
zu machen.
-
Gemäß noch einer
anderen Ausführungsform
betrifft die vorliegende Erfindung eine biologisch resorbierbare
Abdichtungsmittel-Zusammensetzung für die Verwendung in einer Weichteil-Prothese,
die in Kombination mindestens zwei Polysaccharide enthält, die,
wenn sie in einem wässrigen
Medium miteinander gemischt werden, ein Hydrogel bilden. Dieses
Hydrogel bildet eine flüssigkeitsdichte
Versiegelung, wenn es als Abdichtungsmittel auf die Prothese aufgebracht
wird. Gegenstand der Erfindung ist außerdem eine biologisch resorbierbare
Abdichtungsmittel-Zusammensetzung mit kontrollierter Freisetzung,
die zusätzlich
zu der Kombination aus mindestens zwei Polysacchariden außerdem ein
therapeutisches oder biologisch aktives Agens enthält, das
anschließend
an die Implantation in dem Körper
langsam freigesetzt wird, wenn das Abdichtungsmittel allmählich biologisch
abgebaut wird und das Hineinwachsen von Gewebe zunimmt.
-
Verfahren
zur Herstellung und Verwendung der oben genannten Abdichtungsmittel-Zusammensetzungen
und sie enthaltende Prothesen sind ebenfalls Gegenstand der vorliegenden
Erfindung.
-
Detaillierte Beschreibung
der Erfindung
-
Die
vorliegende Erfindung betrifft Abdichtungsmittel-Zusammensetzungen
und implantierbare Weichteil-Prothesen, die mit solchen Zusammensetzungen
imprägniert
sind. Insbesondere betrifft die Erfindung Hydrogel- oder Sol-Gel-Abdichtungsmittel-Zusammensetzungen,
welche die Kombination aus mindestens zwei Polysacchariden enthalten.
Die erfindungsgemäßen Abdichtungsmittel-Zusammensetzungen
bilden eine im Wesentlichen flüssigkeitsdichte,
d.h. blutdichte Versiegelung auf porösen Substratoberflächen und
insbesondere auf den Luminal-Oberflächen von Substraten, wie z.B.
Gefäßtransplantaten.
Diese Abdichtungsmittel-Zusammensetzungen werden mit der Zeit biologisch
abgebaut, wodurch eine Einheilung möglich ist und Endothel-Zellen hineinwachsen
können.
-
Die
erfindungsgemäßen implantierbaren
Weichteil-Prothesen können
aus irgendeinem porösen
Material hergestellt sein, beispielsweise aus irgendeinem synthetischen
oder natürlichen
Polymermaterial, an dem ein Hydrogel oder Sol-Gel wirksam haften
kann. Diese porösen
Materialien können
somit umfassen Polyester, expandiertes (geschäumtes) Poly(tetrafluorethylen),
Nylons, Polypropylene, Polyurethane, Polyacrylnitrile, Polyolefine,
Polycarbonate, hochvernetzte Kollagene, Polylactide, Polyglycoside
und Kombinationen davon. Erfindungsgemäß können auch gewobene oder gewirkte
Transplantate, die aus solchen Materialien hergestellt sind, verwendet
werden. Zusätzlich
können
auch Velour- oder Doppelvelour-Transplantate verwendet werden.
-
Für die Zwecke
der vorliegenden Erfindung beziehen sich die Ausdrücke "Hydrogel" und "Hydrogelmatrix" beide auf ein polymeres
Material, das in Wasser aufquillt, ohne sich aufzulösen, und
das in seiner Struktur eine beträchtliche
Menge Wasser zurückhält.
-
Ein
solches Material weist Eigenschaften auf, die zwischen denjenigen
einer Flüssigkeit
und denjenigen eines Feststoffes liegen. Hydrogele verformen sich
auch elastisch und ziehen sich wieder zusammen, häufig fließen sie
jedoch bei höheren
Spannungen. Für
die Zwecke der vorliegenden Erfindung sind somit Hydrogele in Wasser
aufgequollene dreidimensionale Netzwerke von hydrophilen Polymeren.
-
Im
Gegensatz dazu ist ein Sol-Gel ein Hydrogel, in dem ein Teil der
Struktur gewissermaßen
wasserlöslich
ist. In einem Sol-Gel-System ist somit ein Teil des Materials durch
Wasser extrahierbar, obgleich die Solubilisierungsrate niedrig sein
kann. Daher bezieht sich für
die Zwecke der vorliegenden Erfindung der Ausdruck "Abdichtungsmittel" oder "Abdichtungsmittel-Matrix" entweder auf eine
Hydrogel- oder eine Sol-Gel-Zusammensetzung,
wie sie hier beschrieben ist. Diese Abdichtungsmittel-Matrices können stabiler
gemacht werden durch Vernetzen der Komponententeile derselben. Die
erfindungsgemäßen Abdichtungsmittel-Matrices können auf
mehreren Wegen vernetzt werden. Beispielsweise kann die Ausbildung
von kovalenten Bindungen zwischen einem oder mehreren der Polysaccharide
in der Matrix im Allgemeinen irreversibel eine Vernetzung erzeugen.
Alternativ können
die erfindungsgemäßen Abdichtungsmittel-Matrices
vernetzt werden durch Bildung von ionischen Bindungen in mindestens
einem der Polysaccharide. Bei einem anderen Beispiel können Vernetzungen
entstehen in den erfindungsgemäßen Abdichtungsmittel-Matrices
durch schwächere
intermolekulare Wechselwirkungen, wie z.B. eine Wasserstoffbindung
und spezifische van der Waals-Wechselwirkungen. Bei einem weiteren
Beispiel für
eine erfindungsgemäße Vernetzung
kann ein semikristallines hydrophiles Polymer ein Hydrogel bilden,
wenn die amorphen Regionen eines solchen Polymers Wasser absorbieren
und die in Wasser unlöslichen
kristallinen Regionen (Kristallite) als physikalische Vernetzungen
wirken.
-
Diese
Abdichtungsmittel-Vernetzungsmechanismen können entweder intramolekular
oder intermolekular sein. Außerdem
können
solche Wechselwirkungen zwischen zwei oder mehr Polysacchariden
oder einem Polysaccharid und einem oder mehr anderen hydrophilen
Polymeren auftreten. Es ist schwierig vorherzusagen, ob eine spezielle
Kombination von Polysacchariden, wenn sie unter verschiedenen Bedingungen kombiniert
werden, ein Gelmaterial bildet, das unter physiologischen Bedingungen
stabil ist, mit einem geeigneten Weichmacher kompatibel ist und
geeignet ist, ein implantierbares Transplantat blutdicht zu machen.
In der nachstehenden Tabelle 1 sind daher beispielhaft einige der
erfindungsgemäß hergestellten
Kombinationen von Polysacchariden angegeben. Diese beispielhaften
Polysaccharide wurden be wertet anhand ihrer Fähigkeiten, in einem physiologischen
Phosphatpuffer bei pH 7,2 stabile Gele zu bilden.
-
-
Erfindungsgemäß müssen mindestens
zwei Polysaccharide verwendet werden, um solche Abdichtungsmittel-Matrices
zu definieren. Insbesondere kann hier die folgende Liste von Polysacchariden
verwendet werden: Heparin, Algin, Carboxymethylcellulose, Carrageenan,
z.B. Carrageenan vom Typ I, Carrageenan vom Typ II, Carrageenan
vom Typ III und Carrageenan vom Typ IV; Furcellaran, Agarose, Guargummi,
Johannisbrotgummi, Gummiarabicum, Hydroxyethylcellulose, Hydroxypropylcellulose,
Methylcellulose, Hydroxyalkylmethylcellulose, Pectin, Chitosan;
Stärke
und Stärke-Derivate,
z.B. Amylose und Amylopectin; Xanthan, ihre Salze und Mischungen
davon. Es können
auch bestimmte Proteine und Polyaminosäuren verwendet werden.
-
In
den erfindungsgemäßen Abdichtungsmittel-Matrices
können
auch Plastifizierungsmittel und Weichmacher verwendet werden. Zu
Beispielen für
solche Reagentien gehören
Glycerin, Sorbit und Diole, beispielsweise Polypropylenglycol; teilweise
veresterte Citronensäure,
z.B. Monoethylcitrate; und Milchsäureester, z.B. Ethyllactat,
können
ebenfalls in den erfindungsgemäßen Abdichtungsmittel-Matrices
verwendet werden. Erfindungsgemäß können etwa
0 bis etwa 70 % Plastifizierungsmittel verwendet werden. Es ist
jedoch kritisch, die Konzentration eines Plastifizierungsmittels
in einem speziellen Abdichtungsmittel zu überwachen. Zu viel Plastifizierungsmittel
kann bewirken, dass ein mit einem Abdichtungsmittel imprägniertes
Transplantatmaterial leckt. Diese Plastifizierungsmittel, die in
der oben angegebenen geeigneten Konzentration verwendet werden, sind
vorteilhaft, weil sie die Weichheit und Flexibilität des imprägnierten
implantierbaren Materials erhöhen.
-
In
der nachstehenden Tabelle 2 sind einige der relevanten chemischen
Eigenschaften und Gelbildungs-Eigenschaften von beispielhaften erfindungsgemäßen Polysacchariden
zusammengefasst.
-
-
-
-
Wie
weiter oben angegeben, werden erfindungsgemäß mindestens zwei Polysaccharide
in Kombination als Komponententeile der Abdichtungsmittel-Matrix
verwendet. Diese gepaarten Kombinationen von Polysacchariden umfassen,
ohne dass die Erfindung auf die folgenden Kombinationen beschränkt ist:
Alginsäure/Pectin,
Alginsäure/Chitosan,
Carrageenan vom Typ I/Johannisbrotgummi, Carrageenan vom Typ I/Pectin, Carrageenan
vom Typ II/Johannisbrotgummi, Carrageenan vom Typ II/Pectin, Carrageenan
vom Typ II/Guargummi, Carrageenan vom Typ IV/Johannisbrotgummi,
Johannisbrotgummi/Xanthan, Guargummi/Johannisbrotgummi, Guargummi/Xanthan,
Agar/Guargummi, Proteine und Polyaminosäuren.
-
Es
ist bekannt, dass Ionen, insbesondere K+,
Ca+2 und Mg+2, mit
bestimmten Polysacchariden synergistisch in Wechselwirkung treten
unter Bildung von Gelen. Daher können
mit einem Abdichtungsmittel imprägnierte
Transplantate mit einer Lösung
dieser Ionen in Kontakt gebracht werden, um die Festigkeit des Gels zu
erhöhen.
Erfindungsgemäß können die
mit einem Abdichtungsmittel imprägnierten
Transplantate beispielsweise eingetaucht, imprägniert, besprüht oder
anderweitig auf konventionelle Weise mit einer Lösung von Ionen, wie z.B. K+-, Ca2+- und Mg2+-Ionen in Kontakt gebracht werden, obgleich
auch andere Ionen geeignet sein können. Die Abdichtungsmittel-Matrices
können
daher beispielsweise umfassen Carrageenan vom Typ II, Ca2+-Ionen und Johannisbrotgummi oder Carrageenan
vom Typ IV, Ca2+-Ionen und Johannisbrotgummi.
-
Bei
einer anderen Ausführungsform
der vorliegenden Erfindung können
ein Antikoagulationsmittel oder andere biologisch aktive Agentien
dem Abdichtungsmittel einverleibt werden. Auf diese Weise kann dann, wenn
die Polysaccharidmatrix des Abdichtungsmittels biologisch abgebaut
wird, das biologisch aktive Agens, d.h. das Antikoagulans, mit dem
Ablauf der Zeit kontrollierbar freigesetzt werden. Das Antikoagulans
verbessert somit die Fähigkeit
des Abdichtungsmittels, das Austreten von Blut beispielsweise durch
die Wände
eines porösen
Gefäßtransplantats
zu verhindern. Erfindungsgemäß kann das
Antikoagulans ein Prostaglandin, eine Urokinase, eine Streptokinase,
ein sulfatiertes Polysaccharid, ein Albumin, pharmazeutische Salze
oder Mischungen davon sein. Es können
auch andere geeignete Antikoagulantien verwendet werden. Vorzugsweise ist
das Antikoagulans Heparin oder ein pharmazeutisches Salz davon.
-
Wie
der Typ und die Zusammensetzung der Abdichtungsmittel-Matrix variieren
kann, so gilt dies auch für
den Typ und die Struktur des porösen
implantierbaren Materials. Beispielsweise gehören synthetische Transplantate
allgemein zu einer der beiden folgenden Kategorien: textile Transplantate
oder Extrusionstransplantate. Textile Transplantate werden hergestellt
aus extrudierten Fasern, wie z.B. Dacron-Polyesterfasern. Diese Fasern werden
zu Garnen versponnen und dann werden dar aus schlauchförmige Strukturen
hergestellt durch Wirken oder Weben. Alternativ sind Extrusions-Transplantate
nicht-textile Transplantate, die aus Polymeren hergestellt werden,
wie z.B. aus Polytetrafluorethylen, die extrudiert und mechanisch
verstreckt werden zur Herstellung eines mikroporösen Schlauches. Im Allgemeinen
weisen unbeschichtete Textil-Transplantate eine höhere Wasserpermeationsrate
auf als nichttextile extrudierte Transplantate. Daher wird durch
die Art der Herstellung eines Transplantats seine Porosität beeinflusst.
-
Für die Zwecke
der vorliegenden Erfindung bezeichnet der Ausdruck "porös" oder "Porosität" die relative Anzahl
der offenen oder interstitiellen Hohlräume in der Wand beispielsweise
eines Gefäßtransplantats. Die
Webe- oder Wirkdichte eines textilen Transplantats oder der Grad
der Verstreckung eines extrudierten Transplantats beeinflusst seine
Porosität.
Zu anderen Faktoren, welche die Porosität eines textilen Transplantats
beeinflussen, gehören
der Typ des verwendeten Garns und die angewendete Wirk- oder Webkonfiguration.
Beispielsweise verleihen Transplantatmaterialien, die aus texturierten
Geweben hergestellt sind, denen zusätzliche Garne zugesetzt worden
sind, dem Gewebe eine gefachte oder aufgeraute Struktur und sie
werden als Velour (einseitig) oder Doppelvelour (doppelseitig) bezeichnet.
Traditionell neigen solche Velour-Transplantate weniger zum Bluten
nach der Implantation, weil sie eine größere spezifische Oberfläche aufweisen
und leichter vorher abzudichten sind.
-
Dagegen
weisen Transplantate, die aus geschäumtem PTFE (ePTFE) hergestellt
sind, eine Faserstruktur auf, die durch Zwischenraumknoten definiert
ist, die durch längliche
Fibrillen miteinander verbunden sind. Die Zwischenräume zwischen
den Knotenoberflächen,
die durch die Fibrillen überspannt
werden, sind definiert als internodaler Abstand (IND). Die Porosität eines
ePTFE-Gefäßtransplantats
wird durch Variieren des IND der mikroporösen Struktur des Transplants
gesteuert. Eine Erhöhung
des IND innerhalb einer gegebenen Struktur führt zu einem verstärkten Einwachsen
von Geweben sowie zu einer Endothelzellen-Bildung entlang ihrer
inneren Oberfläche.
Das Einwachsen von Gewebe und die Endothelbildung fördern die
Sta bilität, verbessern
die radiale Festigkeit und erhöhen
die Offenheit (Durchgängigkeit)
des Transplantats.
-
Dementsprechend
können
entweder textile oder extrudierte Materialien zusammen mit den erfindungsgemäßen Abdichtungsmitteln
verwendet werden. Es ist jedoch kritisch, dass die Wände des
eingesetzten Transplantatmaterials ausreichend porös sind,
sodass das Polysaccharid-Hydrogel oder -Sol-Gel in die interstitiellen
Räume desselben
eindringen (imprägnieren)
kann. Für
die Zwecke der vorliegenden Erfindung steht der Ausdruck "Imprägnieren" für das partielle
oder vollständige
Ausfüllen
des interstitiellen Hohlraums, beispielsweise der Poren oder Hohlräume zwischen
den inneren und äußeren Oberflächen beispielsweise
eines Gefäßtransplantats,
um ein solches Transplantat im Wesentlichen blutdicht zu machen.
-
Für die Zwecke
der vorliegenden Erfindung kann die spezifische Porosität eines
Materials durch Verwendung einer Wesolowski-Porositätstest-Vorrichtung
gemessen werden. Bei dieser Apparatur wird ein Transplantat an einem
Ende gelöst
und das freie Ende wird an einem Ventil auf einem Porometer befestigt,
sodass das Transplantat in einer vertikalen Position frei hängt. Danach
lässt man
eine Minute lang Wasser durch das Transplantat laufen und das gesamte
Wasser, das aus dem Transplantat austritt, wird gesammelt und gemessen.
Die spezifische Porosität
des Transplantats wird dann nach der folgenden Formel errechnet:
worin V für das gesammelte Wasservolumen
in ml/min und A für
die Oberflächengröße des dem
Wasser ausgesetzten Transplantats in cm
2 stehen.
Eine spezifische Porosität
von ≤ 1,0
ml/min/cm
2 wird als eine akzeptable Leckage-Menge
für ein
implantierbares Gefäßtransplantat
angesehen. Daher ist für
die Zwecke der vorliegenden Erfindung unter einem im Wesentlichen
blutdichten Transplantat ein Transplantat mit einer spezifischen
Porosität
nach dem Imprägnieren
mit einem erfindungsgemäßen Abdichtungsmittel
von ≤ 1,0 ml/min/cm
2 zu verstehen.
-
Bei
einer anderen Ausführungsform
der vorliegenden Erfindung wird ein Antikoagulans oder ein anderes
biologisch aktives Agens, das innerhalb eines Materials mit kontrollierter
Freisetzung dispergiert ist, verwendet zum Imprägnieren des interstitiellen
Hohlraums zwischen der inneren und äußeren Oberfläche einer porösen implantierbaren
Einrichtung. Das Material mit kontrollierter Freisetzung ist eine
Hydrogelmatrix, die mindestens zwei Polysaccharide, wie vorstehend
beschrieben, enthält.
Wenn nun das Hydrogel durch natürliche
Enzyme, die in dem Körper
vorhanden sind, biologisch abgebaut wird, wird das Antikoagulans
mit dem Ablauf der Zeit langsam freigesetzt. Die Hydrogel-Matrix
verleiht somit beispielsweise einem Gefäßtransplantat nicht nur eine
im Wesentlichen blutdichte Versiegelung, sondern stellt auch, wenn
die Hydrogel-Matrix biologisch abgebaut wird, eine Trägerstruktur
dar, aus der das Antikoagulans oder biologisch aktive Agens kontrolliert
freigesetzt wird. Auf diese Weise verbessert die kontrollierte Freisetzung
des Antikoagulans die Stabilität
dieser Hydrogel-Zusammensetzung zur Verhinderung des Blutverlustes
an den Patienten durch Koagulieren des Blutes, das durch die physikalische
Sperrschicht, die durch das Hydrogel erzeugt wird, entweicht.
-
Nach
Kinam Park et al. in "Biodegradable
Hydrogels For Drug Delivery" (Technomic
Publishing Co. 1993), wird die Arzneimittel-Freisetzung in einem
Hydrogelsystem durch verschiedene Formulierungsvariable und/andere
physikalisch-chemische Eigenschaften der Komponenten in dem System
beeinflusst. So wird zusätzlich
zu dem Abbau des Polymers die Freisetzung des Antikoagulans beeinflusst
durch die physikalischen Parameter des Polymers, wie z.B. den Wassergehalt,
den Vernetzungsgrad, die Kristallinität und die Phasentrennung desselben.
Außerdem
haben die physikalisch-chemischen Eigenschaften des Antikoagulans,
insbesondere seine Löslichkeit
in dem Polymer und in einem wässrigen
Medium und die Menge an Arzneimittel, mit dem das Hydrogel beladen
ist, wie angenommen wird, ebenfalls einen signifikanten Einfluss
auf die Freisetzungseigenschaften des Arzneimittel-Polymer-Verbundmaterials.
Daher variiert die Freisetzungsrate des Antikoagulans mit den vorstehend
angegebenen Variablen. Eine ausreichende Freisetzungsrate kann jedoch vom
Fachmann auf diesem Gebiet durch Einstellung dieser Parameter erzielt
werden.
-
Es
kann jedes konventionelle Verfahren zum Füllen oder Imprägnieren
der interstitiellen Räume
des porösen
Substrats angewendet werden. Beispielsweise wurde eine Abdichtungsmittel-Mischung
gemäß der vorliegenden
Erfindung in einen Glasbehälter
gegeben und ein poröses
Substrat, beispielsweise ein poröses Gefäßtransplantat,
wurde in die Abdichtungsmittel-Mischung eingetaucht. Es wurde ein
Vakuum an den Glasbehälter
angelegt, bis keine Blasen mehr an der Oberfläche des Transplantats oder
in der Lösung
erkennbar waren. Das Vakuum presste das Abdichtungsmittel in die
interstitiellen Räume
des Transplantats. Dann wurde das Transplantat aus der Abdichtungsmittel-Mischung
entnommen, das überschüssige Abdichtungsmittel
wurde entfernt oder ausgepresst und das Ganze wurde trocknen gelassen.
-
Alternativ
kann das Transplantat mit einer erfindungsgemäßen Abdichtungsmittel-Zusammensetzung gefüllt werden
und unter Druck gesetzt werden, um das Eindringen der Zusammensetzung
in die Poren der Transplantat-Wand zu bewirken. Beispielsweise wurde
ein Ende eines porösen
Substrats, beispielsweise eines Gefäßtransplantats, abgelöst. Das
andere Ende des Transplantats wurde mit dem Düsenabschnitt einer 60 cm3-Spritze verbunden. Die Spritze wurde mit
einer erfindungsgemäßen Zusammensetzung
gefüllt
und die Zusammensetzung wurde mittels der Spritze mit einem Kolben
hineingepresst. Auf diese Weise wurde das Transplantat mit der erfindungsgemäßen Zusammensetzung
imprägniert,
d.h. in die interstitiellen Räume
des Transplantats hineingepresst. Wenn einmal das Transplantat mit
der Zusammensetzung gefüllt
war, wurde die Spritze abgezogen und das überschüssige Abdichtungsmittel wurde
aus dem Transplantat entfernt. Das Transplantat wurde dann trocknen
gelassen. Dieses Injektionsverfahren kann so oft wie erforderlich
wiederholt werden, um eine wirksame Imprägnierung des Substrats zu gewährleisten,
beispielsweise kann es bis zu sechsmal wiederholt werden. Andere
Einrichtungen zum Hineinpressen des Abdichtungsmittels in die Zwischenräume zwischen
den Transplantatwänden
sind ebenfalls geeignet.
-
Wie
vorstehend beschrieben, wird das erfindungsgemäße Sol-Gel hergestellt aus
einem teilweise mit Wasser extrahierbaren, beispielsweise wasserlöslichen
Material. Die Löslichkeitsrate
des erfindungsgemäßen Sol-Gel-Materials
ist jedoch sehr nied rig. Das erfindungsgemäße Sol-Gel-Material wird hergestellt
aus mindestens zwei Polysacchariden, wie sie vorstehend beschrieben
sind. Ein solches Sol-Gel-Abdichtungsmittel
ist daher optimal geeignet für
die Erzeugung blutdichter Sperrschichten bei porösen Transplantatmaterialien,
weil ein solches Abdichtungsmittel eine am Anfang blutdichte Oberfläche ergibt,
die langsam biologisch abgebaut wird und/oder solubilisiert wird
zu biologisch kompatiblen Produkten, welche das Einwachsen von Endothel-Zellen
in das Transplantat aus dem umgebenden Gewebe erlauben.
-
Gummis,
wie z.B. Samengummis, sind polymere Substanzen, die in einem geeigneten
Lösungsmittel oder
Quellmittel hochviskose Dispersionen oder Gele mit einem niedrigen
Trockensubstanzgehalt bilden. Insbesondere Samengummi-Polysaccharide
stellen wasserlösliche
Polymere dar, die viskose wässrige
Dispersionen ergeben. Die Samengummi-Polysaccharid-Familie gemäß der vorliegenden
Erfindung umfasst beispielsweise Maisstärke, Guargummi und Johannisbrotgummi,
obgleich auch andere Gummimaterialien geeignet sind. Entsprechend
sind auch Seetang-Extrakt-Polysaccharide
wasserlösliche
Polymere, die viskose wässrige Dispersionen
bilden können.
Daher können
alle Vertreter der Seetang-Extrakt-Polysaccharid-Familie erfindungsgemäß verwendet
werden, wie z.B. Algin, Carrageenan einschließlich der Typen I–IV und
Agar.
-
Bei
einer Ausführungsform
der vorliegenden Erfindung umfasst das Hydrogel eine Kombination
aus einer linearen Polysaccharid-Komponente und einer verzweigten
Polysaccharid-Komponente, dispergiert in einer Glycerin-Wasser-Lösung. Die
erfindungsgemäß verwendeten
linearen Polysaccharide sind wasserlösliche Polymere, die viskose
wässrige
Lösungen
ergeben. Somit können
alle Vertreter der linearen Polysaccharid-Familie erfindungsgemäß verwendet
werden, wie z.B. Algin, Stärkeamylose
und Derivate davon, Carrageenan einschließlich der Typen I–IV, Pectin
und Cellulose-Derivate. In entsprechender Weise stellen die verzweigten
Polysaccharide, die erfindungsgemäß verwendet werden, wasserlösliche Polymere
dar, die viskose wässrige
Dispersionen ergeben. Somit können
alle Vertreter der verzweigten Polysaccharid-Familie erfindungsgemäß verwendet
werden, wie z.B. Guargummi, Xanthan, Johannisbrotgummi, Stärke, Amylopectin
und Derivate davon sowie Gummiarabicum.
-
Die
folgenden Beispiele sollen Verfahren zur Herstellung der erfindungsgemäßen Abdichtungsmittel-Zusammensetzungen
und ihre Verwendung bei porösen
implantierbaren Substraten erläutern.
-
Beispiel 1
-
Carrageenan vom Typ I/Johannisbrotgummi
-
Es
wurden mehrere Präparate
der erfindungsgemäßen Abdichtungsmittel-Zusammensetzungen
in 600 ml-Bechern wie nachstehend beschrieben hergestellt:
-
Abdichtungsmittel-Zusammensetzung
A: Eine Lösung
von Carrageenan vom Typ I (SIGMA Chemical Co., St. Louis, MO) wurde
hergestellt durch Zugabe von 4 g Carrageenan vom Typ I zu 300 ml
Wasser unter konstantem Mischen mit einem Dyna-Mischer. Das in diesem Versuch verwendete
Carrageenan vom Typ I ist überwiegend
die Kappa-Sorte und enthält
geringere Mengen der Lambda-Sorte. Dieses Carrageenan vom Typ I
ist im Handel erhältlich
und wird aus verschiedenen Seetangarten gewonnen. Wenn diese Lösung glatt
war und keine Klumpen sichtbar waren, wurde das Mischen beendet
und es wurden 20 g Glycerin zugegeben und dann wurde von Hand gerührt.
-
Abdichtungsmittel-Zusammensetzung
B: Eine Lösung
von Johannisbrotgummi wurde hergestellt durch Zugabe von 3 g Johannisbrotgummi
zu 300 ml Wasser unter konstantem Rühren mit einem Dyna-Mischer.
Wenn diese Lösung
glatt war und keine Klumpen sichtbar waren, wurde das Mischen beendet
und es wurden 20 g Glycerin zugegeben und dann wurde von Hand gerührt.
-
Abdichtungsmittel-Zusammensetzung
C: Gleiche Mengen (1 : 1-Mischung) der Lösungen A und B wurden durch
Mischen von Hand hergestellt.
-
Die
Fähigkeit
der Lösung
C, gewobene und gewirkte Doppelvelour-Transplantate wasserdicht
zu machen, wurde unter den folgenden drei Bedingungen beurteilt:
-
- (1) die Transplantate wurden mit einem Raumtemperatur-Abdichtungsmittel
beschichtet und dann bei Raumtemperatur getrocknet;
- (2) die Transplantate wurden mit einem Abdichtungsmittel bei
einer Temperatur von 60 °C
beschichtet und dann bei Raumtemperatur getrocknet;
- (3) die Transplantate wurden mit einem Raumtemperatur-Abdichtungsmittel
beschichtet und dann bei 60 °C
getrocknet.
-
Jeder
Parameter wurde dreifach getestet. Für die Zwecke der vorliegenden
Erfindung steht der Begriff "Raumtemperatur" für eine Temperatur
von etwa 22 bis etwa 25 °C.
-
Um
jedes Transplantat mit einer der Abdichtungsmittel-Zusammensetzungen
zu imprägnieren,
wurde das folgende Versuchsprotokoll angewendet: jedes Transplantat
wurde an einer 60 cm3-Spritze befestigt.
Eine Abdichtungsmittel-Zusammensetzung wurde dann in die Spritze
gegeben und in das Transplantat injiziert, bis das Transplantat
voll war und unter Druck stand. Dann wurde das Transplantat entleert,
das überschüssige Abdichtungsmittel
wurde durch Beaufschlagen mit einer Kraft entfernt und trocknen
gelassen. Die bei Raumtemperatur getrockneten Transplantate wurden
etwa 2 bis etwa 4 h lang trocknen gelassen. Die bei 60 °C getrockneten
Transplantate wurden in einem Ofen etwa 30 min bis etwa 1 h lang
getrocknet. Dieses Verfahren wurde sechsmal pro Transplantat wiederholt.
Nach der sechsten Behandlung wurde die Fähigkeit jeder Abdichtungsmittel-Zusammensetzung,
das Transplantat zu versiegeln (abzudichten), getestet durch Messung der
Wasserporosität,
beispielsweise der spezifischen Porosität, des Transplantats, wie weiter
oben beschrieben. In der Tabelle 3 sind die Ergebnisse für jedes
der getesteten Transplantate zusammengefasst.
-
-
Wie
die Daten zeigen, waren die mit dem Abdichtungsmittel imprägnierten
gewobenen Velour-Transplantate signifikant wasserdichter als die
gewirkten Doppelvelour-Transplantate.
Sowohl die gewobenen als auch die gewirkten Transplantate hielten
mehr Wasser zurück,
wenn das Abdichtungsmittel bei 60 °C injiziert worden war. Es sei
darauf hingewiesen, dass alle Transplantate nach der Schlussbeschichtung
weich und flexibel waren und leicht handhabbar waren, ohne dass
das Abdichtungsmittel eine Rissbildung hervorrief.
-
Da
die spezifische Viskosität
aller Transplantate ≥ 1
ml/min/cm2 betrug, war keines dieser Präparate geeignet
für die
Implantation in einen Wirtsorganismus. Daher wur de eine Abdichtungsmittel-Zusammensetzung
aus einem Carrageenan vom Typ II und Johannisbrotgummi ausprobiert.
-
Beispiel 2
-
Carrageenan vom Typ II/Johannisbrotgummi
-
In
einem weiteren Versuch wurden die Abdichtungs-Eigenschaften eines
Carrageenan vom Typ II-Johannisbrotgummi-Hydrogels untersucht. Das
Protokoll für
diesen Versuch war das gleiche wie in Beispiel 1, jedoch mit der
Ausnahme, dass in der Abdichtungsmittel-Zusammensetzung A 4 g des
Carrageenans vom Typ II (SIGMA Chemical Co., St. Louis, MO) anstelle
des Carrageenans vom Typ I verwendet wurden. Bei dem in diesem Versuch
verwendeten Carrageenan vom Typ II handelte es sich überwiegend
um die Iota-Sorte. Zusätzlich
wurde die Abdichtungsmittel-Zusammensetzung allein verwendet zum
Imprägnieren
eines gewobenen Transplantats. Die Ergebnisse des Versuchs sind
in der nachstehenden Tabelle 4 angegeben.
-
-
Wie
die Daten zeigen, waren die mit dem Abdichtungsmittel imprägnierten
gewobenen Transplantate signifikant wasserdichter als die gewirkten
Doppelvelour-Transplantate. Es bestand kein Unterschied in Bezug auf
die Porosität
zwischen den bei Raumtemperatur getrockneten Transplantaten und
den bei 60 °C
getrockneten Transplantaten. Sowohl die gewobenen als auch die gewirkten
Transplantate hielten mehr Wasser zurück, wenn das Abdichtungsmittel
bei 60 °C
injiziert worden war. Die mit dem Carrageenan vom Typ II allein beschichteten
gewobenen Transplantate waren signifikant poröser als die mit der Mischung
aus dem Carrageenan vom Typ II/Johannisbrotgummi beschichteten Transplantate.
Durch das Trocknen des mit Carrageenan vom Typ II beschichteten
Transplantats bei 60 °C
wurde die Wasserdichtheit signifikant verbessert, wie die Porositätstests
zeigten. Alle Transplantate waren nach der Schlussbeschichtung weich
und flexibel und konnten leicht gehandhabt werden, ohne dass das
Abdichtungsmittel eine Rissbildung verursachte. Wie die Daten zeigen,
waren die mit dem Carrageenan vom Typ II/Johannisbrotgummi-Abdichtungsmittel
imprägnierten
gewobenen Transplantate im Wesentlichen wasserdicht, beispielsweise
ergaben sie eine spezifische Porosität von ≤ 1,0 ml/min/cm2. Diese Daten
zeigen, dass eine solche Transplantat-Abdichtungsmittel-Kombination
geeignet ist für
die Implantation in einem Wirtsorganismus.
-
Beispiel 3
-
Carrageenan vom Typ IV/Johannisbrotgummi
-
In
einem weiteren Versuch wurden die Abdichtungseigenschaften eines
Carrageenan vom Typ IV/Johannisbrotgummi-Hydrogels bewertet. Das
Protokoll für
diesen Versuch war das gleiche wie in Beispiel 1, jedoch mit der
Ausnahme, dass in der Abdichtungsmittel-Zusammensetzung A, 4 g Carrageenan
vom Typ IV (SIGMA Chemical Co., St. Louis, MO) anstelle von Carrageenan
vom Typ I verwendet wurden. Das in diesem Versuch verwendete Carrageenan
vom Typ IV bestand überwiegend
aus der Lambda-Sorte. Das in diesem Versuch verwendete Carrageenan
vom Typ IV wurde aus Gigartina aciculare und G. pistillata gewonnen.
Die Ergebnisse dieses Versuchs sind in der nachstehenden Tabelle
5 angegeben.
-
-
Wie
die Daten zeigen, waren die mit dem Abdichtungsmittel imprägnierten
gewobenen Transplantate signifikant wasserdichter als die gewirkten
Doppelvelour-Transplantate. Es bestand kein Unterschied in Bezug auf
die Porosität
zwischen den gewobenen Transplantaten, in die das Abdichtungsmittel
bei 60 °C
injiziert worden war, und den gewobenen Transplantaten, in die das
Abdichtungsmittel bei 23 °C
injiziert worden war. Die gewirkten Transplantate hielten jedoch
mehr Wasser zurück,
wenn das Abdichtungsmittel bei 60 °C injiziert worden war. Es sei
darauf hingewiesen, dass alle Transplantate nach der Schlussbeschichtung
weich und flexibel waren und leicht gehandhabt werden konnten, ohne
dass das Abdichtungsmittel eine Rissbildung hervorrief. Wie die
Daten zeigen, war das Carrageenan vom Typ IV/Johannisbrotgummi-Abdichtungsmittel
ebenso wie das Carrageenan vom Typ II/Johannisbrotgummi-Abdichtungsmittel
in der Lage, ein im Wesentlichen wasserdichtes Transplantat zu ergeben,
das in einen Wirtsorganismus implantiert werden kann.
-
Wie
die Beispiele 1 bis 3 zeigen, waren die Carrageenan-Typen II und
IV wirksamer in Bezug auf die Abdichtung (Versiegelung) der Transplantate,
wenn sie in Kombination mit Johannisbrotgummi verwendet wurden,
als der Carrageenan-Typ I. Die Abdichtungsmittel waren wirksamer,
wenn sie auf gewobene Transplantate angewendet wurden, als bei der
Anwendung auf gewirkte Doppelvelour-Transplantate, hauptsächlich aufgrund
der höheren
Porosität,
welche die gewirkten Konstruktionen aufweisen. Bei den Transplantaten,
die mit Carrageenan vom Typ II und Johannisbrotgummi imprägniert worden
waren, bestand kein Unterschied zwischen den Transplantaten, die
bei Raumtemperatur getrocknet worden waren, und denjenigen Transplantaten, die
bei 60 °C
getrocknet worden waren. Sowohl die gewirkten als auch die gewobenen
Transplantate, in die das Abdichtungsmittel bei 60 °C injiziert
worden war, hielten mehr Wasser bei den Porositätstests zurück als ähnliche Transplantate, in die
das Abdichtungsmittel bei 23 °C
injiziert worden war.
-
Die
gewobenen Transplantate, die mit Carrageenan vom Typ II allein beschichtet
worden waren, führten
zu keinen Ergebnissen, die mit denjenigen der gewobenen Transplantate
vergleichbar waren, die mit der Carrageenan vom Typ II/Johannisbrotgummi-Kombination
beschichtet worden waren. Die Ergebnisse in der Tabelle 4 zeigen
jedoch, dass die mit Carrageenan vom Typ II imprägnierten Transplantate, die
bei 60 °C
getrocknet worden waren, mehr Abdichtungsmittel in dem Transplantat
aufnahmen und weniger porös
waren. Transplantate, die mit der Carrageenan vom Typ IV/Johannisbrotgummigummi-Kombination
beschichtet worden waren, waren vergleichbar mit der Carrageenan
vom Typ II/Johannisbrotgummi-Kombination.
Durch das Trocknungsverfahren wurden die festgestellten Porositätseigenschaften
nicht verändert.
Transplantate, die mit der Carrageenan vom Typ I/Johannisbrotgummi-Kombination
beschichtet worden waren, waren jedoch die porösesten unter den in den Beispielen
1 bis 3 getesteten Abdichtungsmittel-Mischungen.
-
Beispiel 4
-
Agar/Guargummi
-
In
einem Versuch, ein universell anwendbares Abdichtungsmittel zu finden,
beispielsweise ein Abdichtungsmittel, das sowohl gewobene als auch
gewirkte Textil-Transplantate
im Wesentlichen blutdicht macht, wurde ein Versuch durchgeführt mit
einer Mischung, die eine Kombination von Agar und Guargummi enthielt. In
diesem Beispiel wurde die Porosität von Transplantaten getestetet,
die mit einem Hydrogel, hergestellt aus der Kombination von gereinigtem
Agar und Guargummi, imprägniert
worden waren. Das Abdichtungsmittel wurde in zwei gewirkte Transplantate
und zwei Doppelvelour-Transplantate bei 60 °C injiziert, weil gefunden wurde,
dass die Agar/Guargummi-Abdichtungsmittel-Mischung bei 40 °C ein Gel
bildete. Wie in Beispiel 1 wurde bei jedem Transplantat die Injektion
sechsmal durchgeführt.
Einer jedes Transplantat-Typs wurde zwischen den Injektionen bei
Raumtemperatur etwa 1 bis etwa 2 h lang getrocknet (als "Versuch 1" bezeichnet) und
die anderen Transplantate wurden in einem Ofen bei 60 °C etwa 30
min bis etwa 1 h lang getrocknet (als "Versuch 2" bezeichnet). Der Wasserporositätstest wurde
für jedes
Transplantat wie in dem obgen Beispiel 1 beschrieben durchgeführt. Die
Ergebnisse des Porositätstests
für die
gereinigte Agar/Guargummi-Abdichtungsmittel-Zusammensetzung sind
in der nachstehenden Tabelle 6 angegeben.
-
-
In
einem weiteren Versuch wurde die gereinigte Agar/Guargummi-Mischung
wiederum wie vorstehend angegeben getestet, wobei diesmal jedoch
eine andere Charge von gewirkten und Doppelvelour-Transplantaten
verwendet wurde. Wie in der nachstehenden Tabelle 7 angegeben, waren
die Ergebnisse bei beiden Versuchen miteinander vergleichbar.
-
-
Wie
die Ergebnisse der Tabellen 6 und 7 zeigen, waren die bei Raumtemperatur
getrockneten Transplantate weniger porös als die bei 60 °C getrockneten
Transplantate. Es wird angenommen, dass durch die Wärme Wasser
aus dem Transplantat entfernt wird, wodurch der Gelierungsprozess
gestört
wird, was zu den beobachteten höheren
Porositätsergebnissen
führt.
Außerdem
waren die bei Raumtemperatur getrockneten Transplantate flexibler
als das bei 60 °C
getrocknete Transplantat. Die Ergebnisse zeigen, dass die gereinigten Agar/Guargummi-Abdichtungsmittel
vergleichbar waren mit den Carrageenan-Typen II und IV/Johannisbrotgummi- Abdichtungsmittel-Mischungen.
Tatsächlich
lassen die Daten aus den Tabellen 6 und 7 vermuten, dass die Agar/Guargummi-Abdichtungsmittel-Mischung
nach dem Trocknen bei Raumtemperatur gut geeignet ist, um sowohl
gewobene als auch gewirkte Transplantate blutdicht zu machen.
-
Beispiel 5
-
In
diesen Beispiel sind die Daten von verschiedenen Porositätsversuchen,
die wie in Beispiel 1 durchgeführt
wurden, angegeben. In diesem Versuch wurde die Porosität von gewirkten
und gewobenen Transplantaten bewertet durch Veränderung verschiedener Parameter,
wie z.B. der verwendeten Polysaccharide, der Konzentration und des
Verhältnisses
der verschiedenen Polysaccharide, der Glycerin-Konzentration sowie der Temperatur des
Abdichtungsmittels und des Trocknungsverfahrens. Diese Daten sind
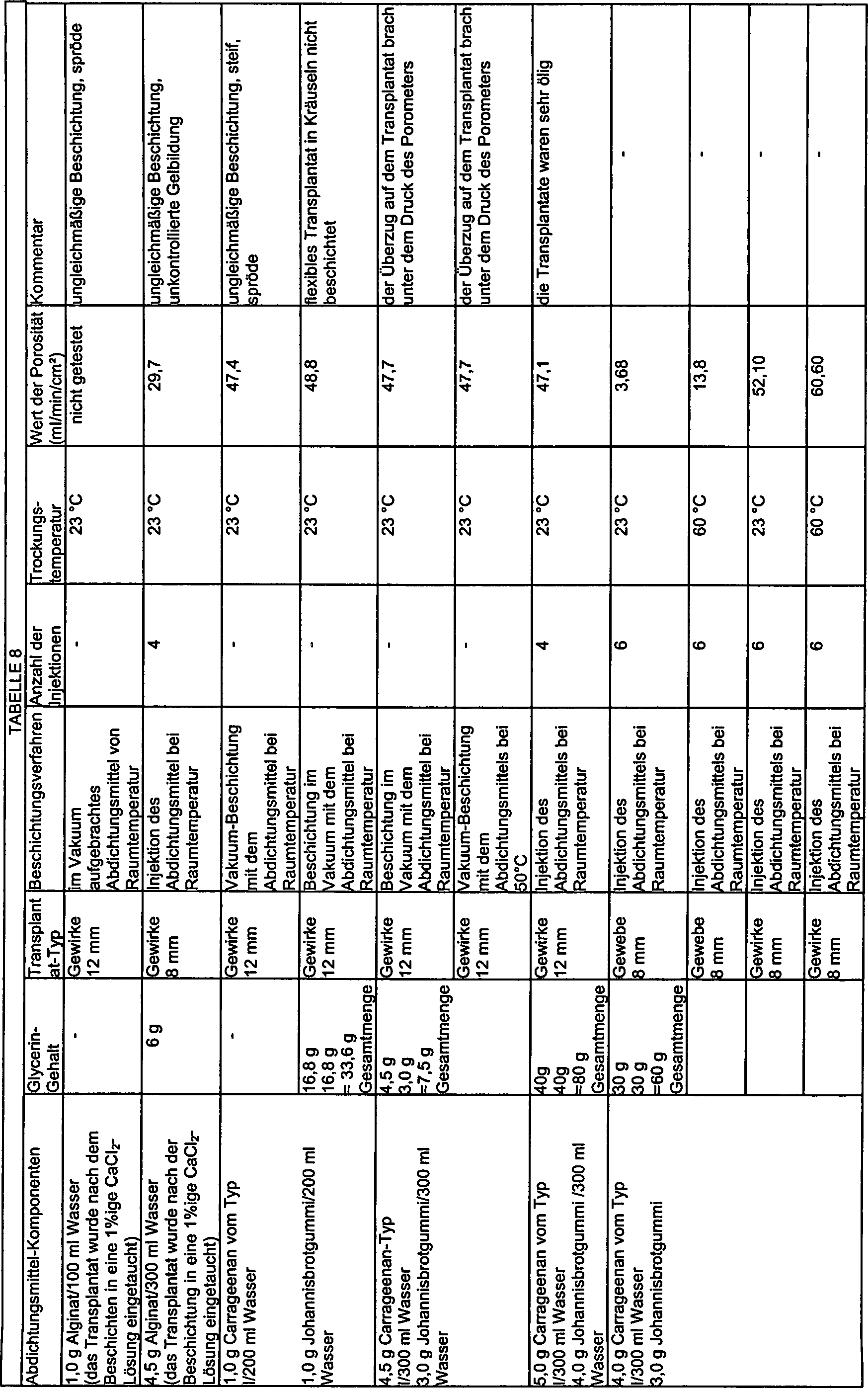
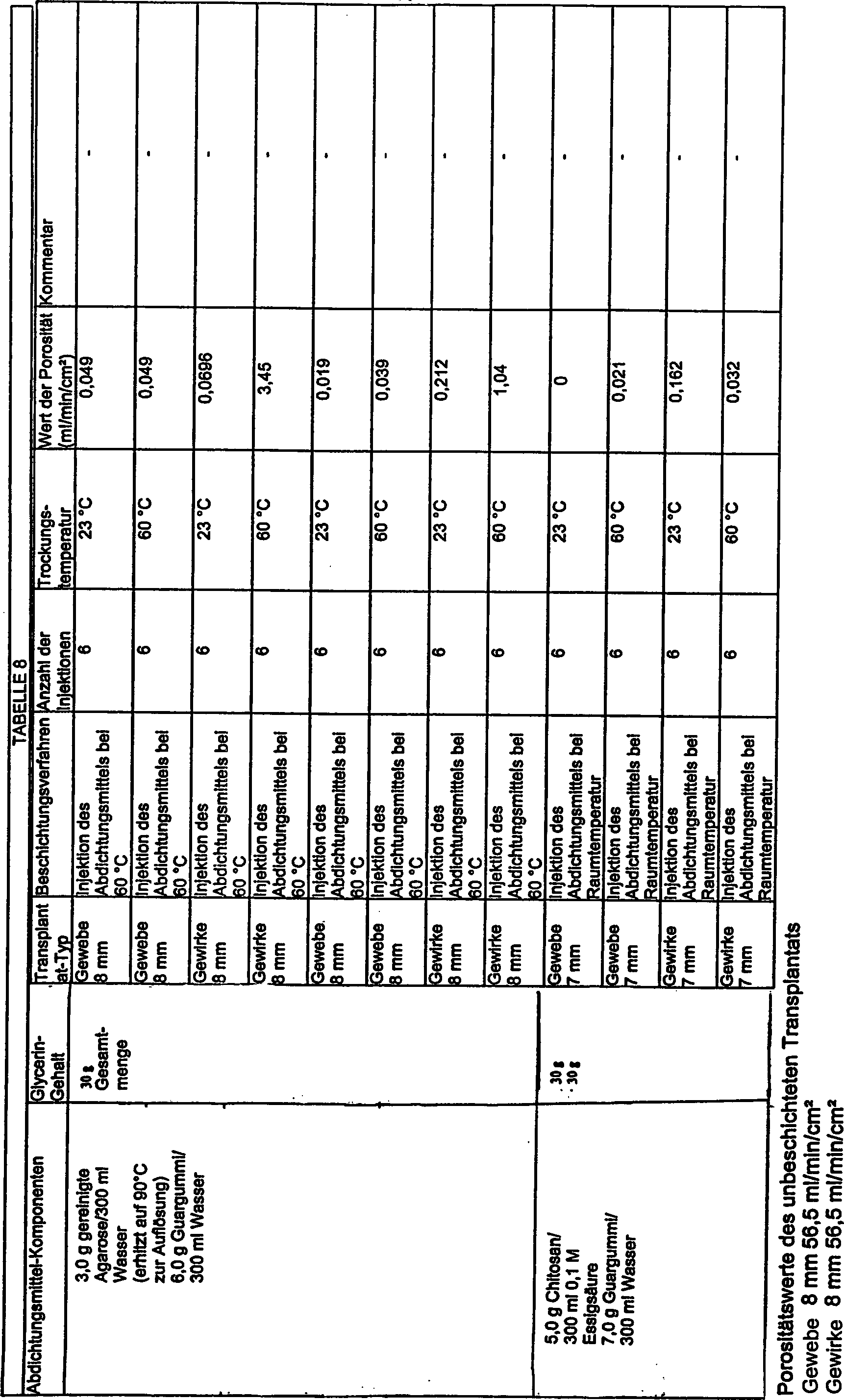
in der nachstehenden Tabelle 8 zusammengefasst.
-
-
-
-
-
-
Diese
Daten zeigen, dass Abdichtungsmittel-Mischungen aus Carrageenan
vom Typ IV/Guargummi, Carrageenan vom Typ IV/Johannisbrotgummi,
Agarose/Guargummi und Chitosan/Guargummi Abdichtungsmittel-Kombinationen
sind, die universell in der Lage sind, im Wesentlichen blutdichte
Sperrschichten zu ergeben sowohl bei Gewebe-Transplantaten als auch
bei Gefäßtransplantaten.
-
Bezüglich der
vorstehend beschriebenen Erfindung ist es klar, dass sie in vielerlei
Hinsicht abgeändert werden
kann. Diese Abänderungen
werden jedoch nicht als Abweichung von dem Geist und Bereich der
Erfindung angesehen und alle diese Modifikationen liegen innerhalb
des Schutzbereiches der nachfolgenden Patentansprüche.