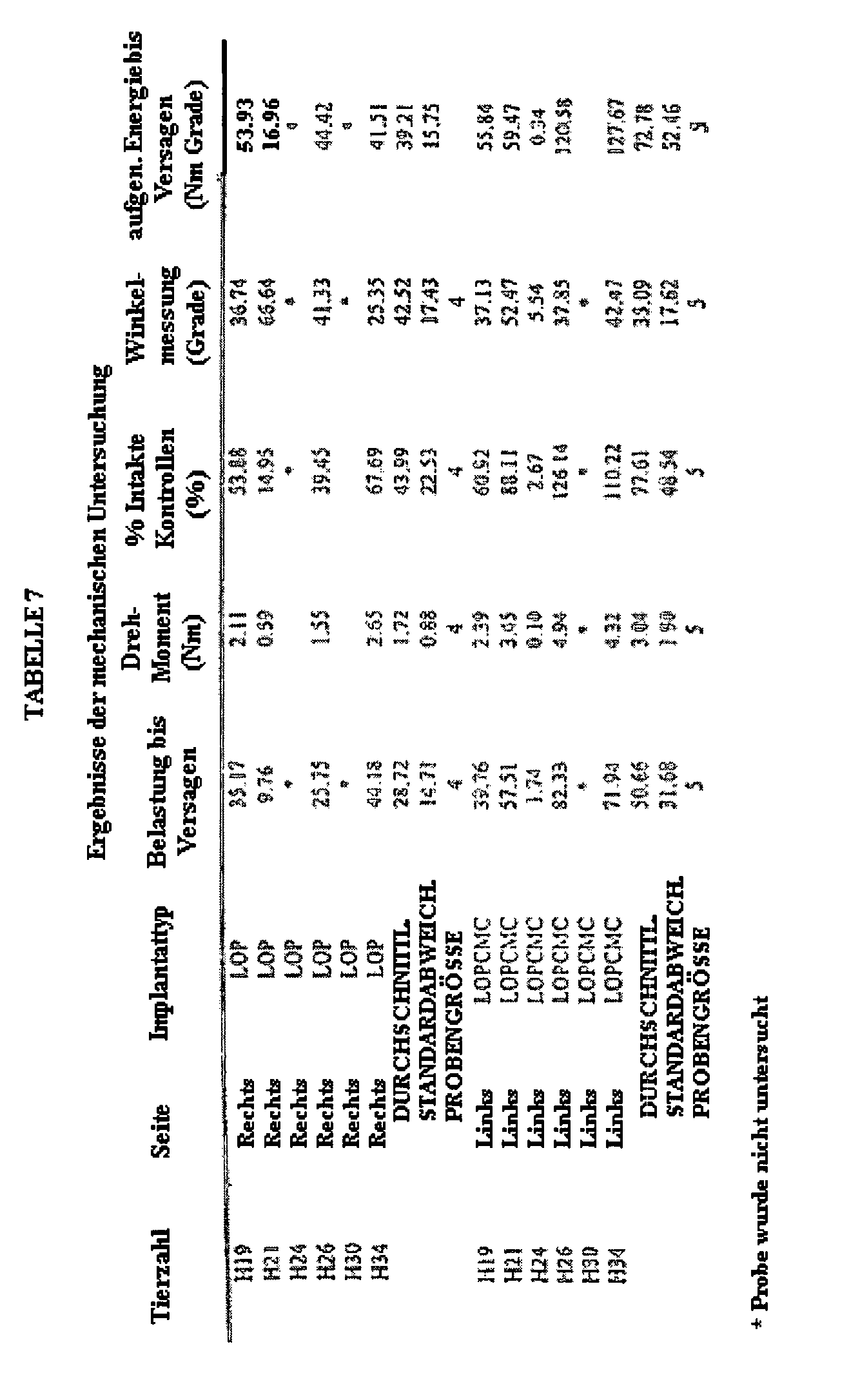
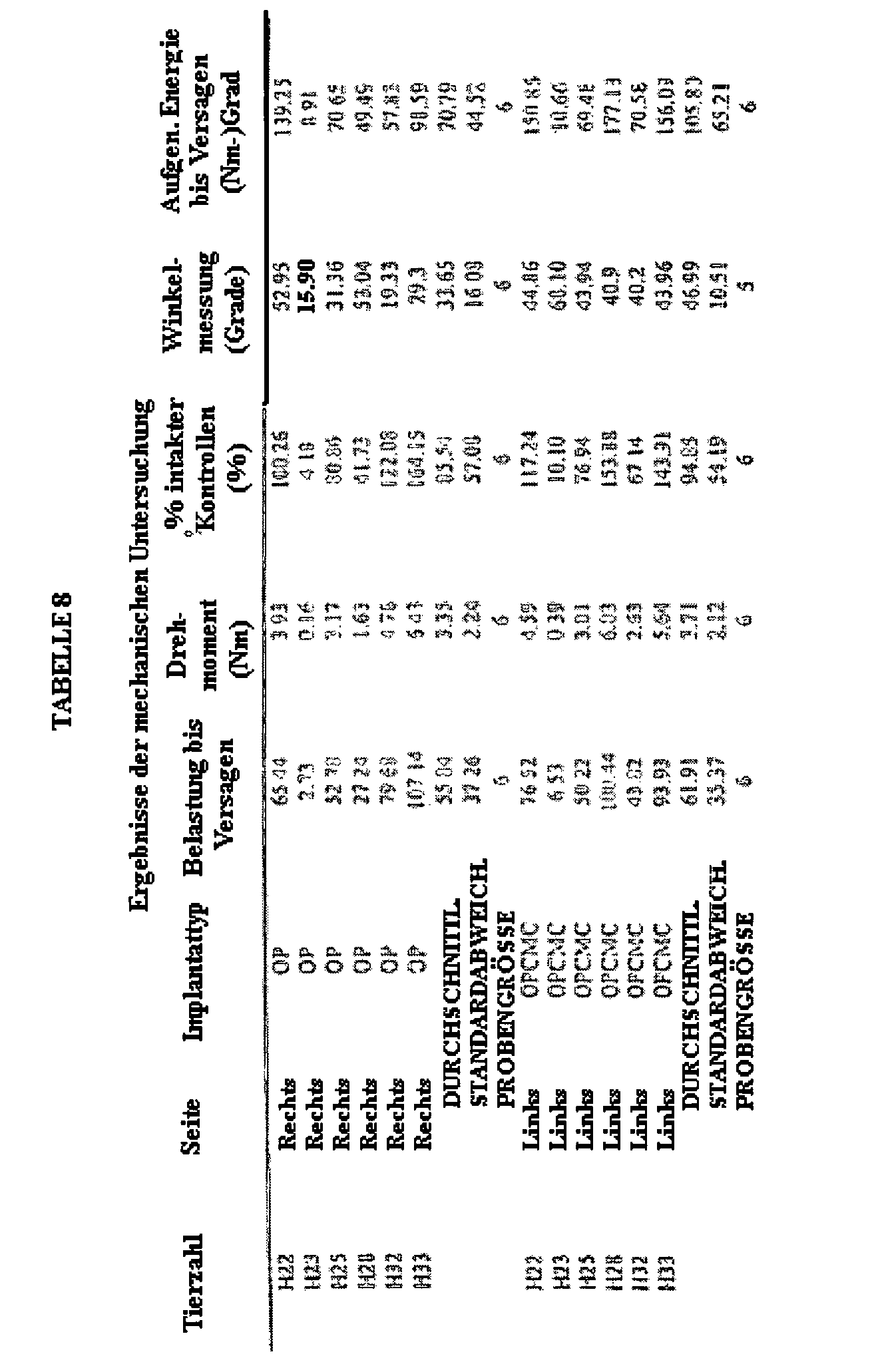
-
Gebiet der Erfindung
-
Die
hierin offenbarte Erfindung betrifft Materialien und Verwendungen
zum Reparieren von Knochen- und Knorpeldefekten unter Verwendung
von osteogenen Proteinen.
-
Hintergrund der Erfindung
-
Es
ist jetzt eine Klasse von Proteinen identifiziert worden, die im
Stande sind, als wahre chondrogene Gewebe-Morphogene zu agieren.
Das heißt,
dass diese Proteine in der Lage sind, die Proliferation und Differenzierung
von Vorläufer-Zellen
in funktionelles Knochen-, Knorpel-, Sehnen- und/oder Bandgewebe
alleine zu induzieren. Diese Proteinklasse, die hierin als „osteogene
Proteine" oder „morphogenetische
Proteine" oder „Morphogene" bezeichnet wird,
umfasst Mitglieder der Familie der morphogenetischen Knochenproteine (BMPs),
welche ursprünglich
durch ihre Fähigkeit
identifiziert wurden, ektopische, endochondrale Knochenmorphogenese
zu induzieren. Die osteogenen Proteine werden im Fachgebiet im Allgemeinen
als eine Untergruppe der Wachstumsfaktoren der TGF-β-Superfamilie klassifiziert
(Hogan (1996) Genes & Development 10:1580-1594).
Mitglieder der Familie morphogenetischer Proteine umfassen das osteogene
Protein-1 aus Säugern (OP-1,
auch bekannt als BMP-7, und das Drosophila-Homolog 60A), osteogene
Protein-2 (OP-2, auch bekannt als BMP-8), osteogene Protein-3 (OP-3),
BMP-2 (auch bekannt als BMP-2A oder CBMP-2A, und das Drosophila-Homolog
DPP), BMP-3, BMP-4 (auch bekannt als BMP-2B oder CBMP-2B), BMP-5,
BMP-6 und sein murines Homolog Vgr-1, BMP-9, BMP-10, BMP-11, BMP-12,
GDF3 (auch bekannt als Vgr2), GDF8, GDF9, GDF10, GDF11, GDF12, BMP-13,
BMP-14, BMP-15,
GDF-5 (auch bekannt als CDMP-1 oder MP52), GDF-6 (auch bekannt als
CDMP-2), GDF-7 (auch
bekannt als CDMP-3), das Xenopus-Homolog Vgl und NODAL, UNIVIN,
SCREW, ADMP und NEURAL. Mitglieder dieser Familie codieren abgesonderte
Polypeptidketten, die gemeinsame strukturelle Merkmale teilen, einschließlich der
Prozessierung von einer Vorläufer "Pro-Form", um eine reife Polypeptidkette
zu ergeben, die zur Dimerisierung im Stande ist und eine aktive
carboxyterminale Domäne
von ungefähr
97-106 Aminosäuren
enthält.
Alle Mitglieder teilen in dieser Domäne ein konserviertes Muster
an Cysteinen und die aktive Form dieser Proteine kann entweder ein
Disulfid-gebundenes Homodimer eines einzelnen Familienmitglieds
sein oder ein Heterodimer von zwei unterschiedlichen Mitgliedern
sein (siehe z.B. Massague (1990) Annu. Rev. Cell Biol. 6:597; Sampath,
et al. (1990) J. Biol. Chem. 265:13198). Siehe auch
US 5,011,691 ; U.S. 5,266,683, Ozkaynak
et al. (1990) EMBO J. 9: 2085-2093, Wharton et al., (1991) PNAS
88:9214-9218), (Ozkaynak (1992) J. Biol. Chem. 267:25220-25227 und
US 5,266,683 ); (Celeste
et al. (1991) PNAS 87:9843-9847); (Lyons et al., (1989) PNAS 86:4554-4558).
Diese Offenbarungen beschreiben die Aminosäure- und DNA-Sequenzen sowie
auch die chemischen und physikalischen Eigenschaften dieser osteogenen
Proteine. Siehe auch Wozney et al. (1988) Science 242:1528-1534);
BMP-9 (WO93/00432, veröffentlicht
am 7. Januar 1993); DPP (Padgett et al. (1987) Nature 325:81-84;
und Vg-1 (Weeks (1987) Cell 51:861-867).
-
Wahre
osteogene Proteine, die im Stande sind, die vorstehend beschriebene
Kaskade von morphogenetischen Ereignissen zu induzieren, die in
endochondraler Knochenbildung resultieren, sind auf diese Weise
jetzt identifiziert, isoliert und cloniert worden. Ob natürlich vorkommend
oder synthetisch erzeugt, können diese
osteogenen Faktoren, wenn sie gemeinsam mit einer Matrix oder einem
Substrat, in einen Säuger
implantiert werden, die/das Anlagerung, Proliferation und Differenzierung
von wandernden Vorläuferzellen
ermöglicht,
die Rekrutierung von zugänglichen
Vorläuferzellen
induzieren und ihre Proliferation stimulieren und dadurch die Differenzierung
in Chondrocyten und Osteoblasten induzieren und ferner die Differenzierung
von Zwischenknorpel, Gefäßneubildung,
Knochenbildung, Umbau und schließlich Knochenmarkdifferenzierung
induzieren. Darüber
hinaus haben zahlreiche Praktiker die Fähigkeit dieser osteogenen Proteine
bewiesen, wenn sie entweder mit Matrixmaterialen aus natürlichen
Quellen wie zum Beispiel Kollagen oder synthetisch erzeugten polymeren
Matrixmaterialien gemischt wurden, Knochenbildung, einschließlich endochondraler Knochenbildung,
unter Bedingungen zu induzieren, bei denen wahrer Ersatz des Knochens
sonst nicht vorkommen würde.
Zum Beispiel wenn diese osteogenen Proteine gemeinsam mit einem
Matrixmaterial die Bildung von neuem Knochen in großen segmentalen
Knochendefekten, operativen Wirbelsäulenversteifungen und Brüchen induzieren.
-
Aus
der Natur stammende Matrizen wie zum Beispiel Kollagen können mit
inerten Materialen wie zum Beispiel Plastik ersetzt werden, aber
Plastik ist kein geeigneter Ersatz, das es nicht resorbiert wird
und auf Anwendungen begrenzt ist, die einfache geometrischen Konfigurationen
benötigen.
Bis heute sind auch biologisch abbaubare Polymere und Co-Polymere
als Matrizen vermischt mit osteogenen Proteinen, für die Reparatur
von Pseudoarthrose-(„non-union")-Defekten verwendet
worden. Während
solche Matrizen manche dieser vorstehend beschriebenen Mängel überwinden
können,
erfordert die Verwendung dieser Matrizen die Bestimmung und Kontrolle
von Merkmalen wie zum Beispiel Polymerchemie, Partikelgröße, Biokompatibilität und andere
Einzelheiten, die für
die Funktionsfähigkeit
entscheidend sind. Zum Beispiel müssen Poren im Polymer in einer
Weise geformt sein, welche die Anlagerung von Protein in die Matrix
sowie den Bioabbau der Matrix sicherstellt. Vor der Verwendung der
polymeren Matrix ist es daher notwendig, einen zusätzlichen
Behandlungsschritt des Polymers zu durchlaufen, um die Bildung von
Poren der geeigneten Größe zu induzieren.
-
Osteogene
Standardvorrichtungen, die entweder Kollagen- oder Polymer-Matrizen in Beimischung
mit einem osteogenen Protein umfassen, sind für die Manipulation während der
Operation weniger zugänglich. Osteogene
Standardvorrichungen haben oft eine trockene, sandige Konsistenz
und können,
wann immer die Defekt-Stelle während
der Operation gespült
wird, und/oder durch Blut und/oder andere Flüssigkeiten, welche die Stelle
nach der Operation infiltrieren, weggewaschen werden. Das Hinzufügen bestimmter
Materialien zu diesen Zusammensetzungen kann bei der Bereitstellung
einer besser handhabbaren Zusammensetzung für den Umgang während der
Operation helfen. Die Patente der Vereinigten Staaten, Nr. 5,385,887;
5,520,923; 5,597,897 und die Internationalen Veröffentlichung WO 95/24210 beschreiben
Zusammensetzungen, die für einen
solchen Zweck eine synthetische polymere Matrix, osteogenes Protein
und einen Träger
verwenden. Solche Zusammensetzungen sind jedoch aufgrund eines Bestrebens,
bestimmte, vermeintliche, nachteilige, immunologische Reaktionen
zu überwinden,
von welchen angenommen wird, dass sie mit anderen Arten von Matrizen
in Zusammenhang stehen, insbesondere mit biologisch-abstammenden
Matrizen, einschließlich mancher
Arten von Kollagen, auf synthetische Polymermatrizen beschränkt gewesen.
Diese Zusammensetzungen leiden daher an den gleichen, vorstehend
beschriebenen Durchführbarkeitsbedenken
für die
Optimierung von Polymerchemie, Partikelgröße, Biokompatibilität usw. WO
94/15653 beschreibt Formulierungen zur Induktion von Knochenwachstum,
umfassend TGF-β,
TCP und einem Träger
wie zum Beispiel Kollagen, CMC und Cellulosederivate. WO 94/20133
beschreibt Gewebe-Abdichtungsmittel, umfassend Fibrinkleber, entmineralisierten
Knochen und BMPs. Es verbleiben die Erfordernisse für Zusammensetzungen
und Verfahren für die
Reparatur von Knochen- und Knorpeldefekten, welche größere Leichtigkeit
in der Handhabung während der
Operation bereitstellen und die nicht auf synthetische Polymer-Matrizen
angewiesen sind. Ferner verbleiben die Erfordernisse für Verfahren
und Zusammensetzungen, welche die Geschwindigkeit und Qualität von neuer
Knochen- und Knorpelbildung erhöhen.
-
Demgemäß ist es
ein Gegenstand der vorliegenden Erfindung, verbesserte osteogene
Vorrichtungen und Verfahren der Verwendung davon zur Reparatur von
Knochendefekten, Knorpeldefekten und/oder osteochondralen Defekten
bereitzustellen, die während
der Operation leichter zu manipulieren sind; die Bedenken von Polymerchemie,
Partikelgröße und Biokompartibilität umgehen,
die mit der Verwendung von synthetischen Polymermatrizen in Zusammenhang
stehen; und welche die beschleunigte Knochenbildung und stabilere Knorpelreparatur
unter Verwendung von niedrigeren Dosierungen an osteogenem Protein
erlauben, als unter Verwendung von im Fachgebiet bekannten Vorrichtungen
und Verfahren erreicht werden kann. Es ist ein weiterer Gegenstand
der vorliegenden Erfindung, osteogene Vorrichtungen und Verfahren
der Verwendung davon zur Reparatur von nicht-heilenden, Pseudoarthrose-Defekten
und zur Förderung
von Gelenkknorpelreparatur in chondralen und osteochondralen Defekten
bereitzustellen. Noch ein weiterer Gegenstand der vorliegenden Erfindung
ist es, Vorrichtungen und Verwendungen von Vorrichtungen für die Reparatur
von Knochen- und Knorpeldefekten ohne operativen Eingriff bereitzustellen.
Diese und andere Gegenstände,
gemeinsam mit Vorteilen und Merkmalen der hierin offenbarten Erfindung,
werden aus der Beschreibung, den Zeichnungen und den Ansprüchen, die
folgen, offenkundig sein.
-
Zusammenfassung der Erfindung
-
Die
vorliegende Erfindung basiert auf der Entdeckung, dass das Mischen
von osteogenem Protein und einer nichtsynthetischen, nichtpolymeren
Matrix wie zum Beispiel Kollagen oder β-Tricalciumphosphat (β-TCP) mit
einem Bindemittel, ausgewählt
aus der Gruppe, bestehend aus Carboxymethylcellulose und einem Natriumsalz
davon, wobei das Bindemittel eine Viskosität von etwa 10-200 cP und einen
Substitutionsgrad von 0,65-0,90 hat, eine verbesserte osteogene
Vorrichtung, mit erhöhten
Knochen- und Knorpel-Reparaturfähigkeiten
ergibt. Solche verbesserten Vorrichtungen können nicht nur die Reparaturgeschwindigkeit
beschleunigen, diese Vorrichtungen können auch die Bildung von hoch
qualitativer, stabiler Gewebereparatur, insbesondere von Knorpelgewebe,
fördern.
Außerdem
können
die vorhergehenden Vorteile unter Verwendung von erheblich weniger
osteogenem Protein erzielt werden, als bei osteogenen Standardvorrichtungen
benötigt
wird. Während
wir nicht durch Theorie gebunden sein möchten, können die vorstehend erwähnten, unerwarteten Eigenschaften
wahrscheinlich auf eine komplementäre oder synergistische Interaktion
zwischen der nichtpolymeren Matrix und dem Bindemittel zurückgeführt werden.
Im Lichte von bestehenden orthopädischen
und rekonstruktiven Technologien sind diese Entdeckungen unerwartet
und man war sich ihrer vordem nicht bewusst.
-
Die
Erfindung stellt in einem Aspekt eine neue Vorrichtung zur Induktion
von lokaler Knochen- und Knorpelbildung bereit, umfassend ein osteogenes
Protein, Matrix, stammend aus nicht-synthetischem, nicht-polymerem
Material, und ein Bindemittel, ausgewählt aus der Gruppe, bestehend
aus Carboxymethylcellulose und einem Natriumsalz davon, wobei das
Bindemittel eine Viskosität
von etwa 10-200 cP und einen Substitutionsgrad von 0,65-0,90 aufweist.
Wie hierin in Erwägung
gezogen wird, umfasst die Vorrichtung vorzugsweise osteogene Proteine
wie zum Beispiel, aber nicht darauf limitiert, OP-1, OP-2, BMP-2,
BMP-4, BMP-5 und BMP-6. Ein zurzeit bevorzugtes osteogenes Protein
ist OP-1. Wie hierin verwendet, schließen die Begriffe „Morphogen", „Knochen-Morphogen", „Knochen-morphogenetisches
Protein", „BMP", „osteogenes
Protein" und „osteogener
Faktor" die Klasse
von Proteinen ein, die durch menschliches osteogenes Protein 1 (hOP-1) verkörpert wird.
Nucleotid- und Aminosäuresequenzen
für hOP-1
werden in den SEQ ID NOs: 1 bzw. 2 bereitgestellt. Zur Erleichterung
der Beschreibung wird hOP-1 hierin nachstehend als ein repräsentatives
osteogenes Protein dargestellt. Der Fachmann wird sich jedoch darüber im Klaren
sein, dass OP-1 lediglich ein Repräsentant der TGF-β-Unterklasse der wahren
Gewebemorphogene ist, die im Stande sind, als osteogene Proteine
zu wirken und nicht dazu gedacht sind, die Erfindung zu limitieren.
Andere bekannte und nützliche Proteine
umfassen BMP-2, BMP-3, BMP-3b, BMP-4, BMP-5, BMP-6, BMP-8, BMP-9,
BMP-10, BMP-11, BMP-12, BMP-13, BMP-15, GDF-1, GDF-2, GDF-3, GDF-5,
GDF-6, GDF-7, GDF-8, GDF-9, GDF-10, GDF-11, GDF-12, NODAL, UNIVIN,
SCREW, ADMP, NEURAL und osteogen aktive Aminosäurevarianten davon. In einer
bevorzugten Ausführungsform
schließen
die in der Erfindung nützlichen
Proteine biologisch aktive Artvarianten aller dieser Proteine ein,
einschließlich
konservierter Aminosäure-Sequenzvarianten,
Proteine, die durch degenerative Nucleotid-Sequenzvarianten codiert
werden, und osteogen aktiver Proteine, welche das wie hierin definierte
konservierte 7-Cystein-Skelett teilen und durch eine DNA-Sequenz
codiert sind, die an eine DNA-Sequenz hybridisieren kann, die ein
hierin offenbartes osteogenes Protein codiert, einschließlich, ohne
Limitierung, OP-1, BMP-5, BMP-6, BMP-2, BMP-4 oder GDF-5, GDF-6
oder GDF-7. In einer anderen Ausführungsform schließen nützliche
osteogene Proteine jene ein, welche die konservierte Sieben-Cystein-Domäne teilen
und die eine Aminosäure-Sequenzhomologie
(Ähnlichkeit)
von mindestens 70% innerhalb der C-terminalen aktiven Domäne aufweisen,
wie hierin definiert. In noch einer anderen Ausführungsform können die
osteogenen Proteine der Erfindung als osteogen aktive Proteine definiert
werden, die eine der hierin definierten generischen Sequenzen aufweisen,
einschließlich
OPX (SEQ ID NO: 3) und die generischen Sequenzen 7 und 8 oder die
generischen Sequenzen 9 und 10.
-
OPX
enthält
die Homologien zwischen verschiedenen Arten der osteogenen OP-1-
und OP-2-Proteine und wird durch die hierin nachstehend und in SEQ
ID NO: 3 gezeigte Aminosäuresequenz
beschrieben. Die generische Sequenz 9 ist eine Sequenz aus 96 Aminosäuren, welche
das durch hOP-1 definierte Sechs- Cystein-Skelett
(Reste 335-431 von SEQ ID NO: 2) enthält, wobei die verbleibenden
Reste die Homologien von OP-1, OP-2, OP-3, BMP-2, BMP-3, BMP-4,
BMP-5, BMP-6, BMP-8,
BMP-9, BMP-10, BMP-11, BMP-15, GDF-1, GDF-3, GDF-5, GDF-6, GDF-7, GDF-8, GDF-9,
GDF-10, GDF-11, UNIVIN, NODAL, DORSALIN, NURAL, SCREW und ADMP enthalten.
Das heißt,
dass jeder der nicht-Cysteinreste unabhängig aus dem korrespondierenden
Rest in dieser aufgelisteten Proteingruppe ausgewählt wird.
Die generische Sequenz 10 ist eine Sequenz aus 102 Aminosäuren, welche
eine 5-Aminosäuren-Sequenz
umfasst, welche an den N-Terminus der generischen Sequenz 9 hinzugefügt wurde,
und das 7-Cystein-Skelett von hOP-1 definiert (330-431 SEQ ID NO: 2).
Die generischen Sequenzen 7 und 8 sind Sequenzen aus 96 bzw. 102
Aminosäuren,
welche entweder das 6-Cystein-Skelett (generische Sequenz 7) oder
das durch hOP-1 definierte 7-Cystein-Skelett (generische Sequenz
8) enthalten, wobei die verbleibenden nicht-Cysteinreste die Homologien
von OP-1, OP-2,
OP-3, BMP-2, BMP-3, BMP-4, 60A, DPP, Vgl, BMP-5, BMP-6, Vgr-1 und
GDF-1 enthalten.
-
Wie
nachstehend gelehrt wird, sind die bevorzugten Matrizen nicht-synthetische, nicht-polymere
Materialien und können
aus natürlichen
Quellen stammen oder abgeleitet aus biologischen Materialien sein.
Beispiele von bevorzugten Matrizen umfassen, sind aber nicht beschränkt auf,
Kollagen, entmineralisierten Knochen und β-TCP. Eine zurzeit bevorzugte
Matrix ist Kollagen. Eine andere gegenwärtig bevorzugte Matrix ist β-TCP. Die
Vorrichtungen der vorliegenden Erfindung umfassen daher als primäre Komponenten
keine synthetischen polymeren Matrizen wie zum Beispiel Homopolymere
oder Co-Polymere
aus α-Hydroxy-Essigsäure und/oder α-Hydroxy-Propionsäure, einschließlich racemischer
Gemische davon.
-
Im
Hinblick auf Bindemittel umfassen die vorliegenden Vorrichtungen
Mittel, die als gelbildende, Viskositäts-steigernde, suspendierende
und/oder emulgierende Mittel nützlich
sind, wobei dieses Mittel ausgewählt
wird aus der Gruppe, bestehend aus Carboxymethylcellulose und einem
Natriumsalz davon, wobei das Bindemittel eine Viskosität von etwa
10-200 cP und einen Substitutionsgrad von 0,65-090 aufweist. Das
Bindemittel ist eine Alkylcellulose, insbesondere Methylcellulosen
wie zum Beispiel Carboxymethylcellulose. Andere Bindemittel, die
hierin beschrieben werden, können
andere Cellulosegummis, Natriumalginat, Dextrane und Gelatinepulver
sein. Ein anderes, hierin beschriebenes Bindemittel kann Fibrinkleber
sein.
-
Wie
hierin verwendet, bedeutet der Begriff „Fibrinkleber" eine Zusammensetzung,
umfassend Säuger-Fibrinogen
und Thrombin. In bestimmten Ausführungsformen
umfasst die verbesserte Vorrichtung der vorliegenden Erfindung weiterhin
ein Benetzungsmittel wie zum Beispiel, aber nicht darauf beschränkt, Kochsalz oder
andere wässrige
physiologische Lösungen.
-
Die
verbesserten Vorrichtungen der vorliegenden Erfindung können eine
Vielzahl an Konfigurationen annehmen. Die Konfiguration wird teilweise
von der Art des eingesetzten Bindemittels und Benetzungsmittels abhängen. Wie
hierin offenbart, kann eine gegenwärtig bevorzugte Ausführungsform
Kittkonsistenz aufweisen. Diese bestimmte Konfiguration ist insbesondere
in der Behandlung von offenen Defekten gemäß den Verfahren der vorliegenden
Erfindung nützlich.
Eine andere zurzeit bevorzugte Ausführungsform der verbesserten osteogenen
Vorrichtung kann die Konsistenz einer viskosen Flüssigkeit
aufweisen. Diese bestimmte Konfiguration ist besonders bei der Behandlung
von geschlossenen Defekten gemäß den hierin
offenbarten Verfahren nützlich.
Abhängig
von der Zusammensetzung der verbesserten Vorrichtung kann die Bereitstellung
an die Defekt-Stelle durch eine Vielzahl von Verabreichungsformen
erzielt werden. Zum Beispiel kann ein Kitt in und/oder um den Defekt
gepackt werden oder als ein Kügelchen
aus einem Gerät
mit großem
Loch herausgedrückt
werden. Alternativ kann eine viskose Flüssigkeit in und/oder um den
Defekt injiziert werden oder alternativ auf die Oberfläche(n) des
Defekts aufgestrichen und/oder aufgepinselt werden. Die Nutzung
einer Vielzahl dieser möglichen
Ausführungsformen
zur Reparatur von Knochen- und Knorpeldefekten wird hierin beispielhaft
beschrieben.
-
Unter
den Eigenschaften des Bindemittels, welches aus der Gruppe ausgewählt wurde,
bestehend aus Carboxymethylcellulose und einem Natriumsalz davon,
wobei das Bindemittel eine Viskosität von etwa 10-200 cP und einen
Substitutionsgrad von 0,65-0,90 aufweist, ist eine Fähigkeit,
die Vorrichtung geschmeidig, formbar und/oder anpassungsfähig; injizierbar;
anlagerungsfähig
an Knochen, Knorpel, Muskel und andere Gewebe; resistent gegen Zerfall
nach Waschen und/oder Spülen
während
der Operation; und resistent gegen Entfernung während der Operation, des Nähens und
nach der Operation, zu machen, um nur einige zu nennen. Außerdem kann
dieses Bindemittel in bestimmten, bevorzugten Ausführungsformen
die vorstehend erwähnten
Merkmale und Vorteile erzielen, wenn es in geringen Anteilen vorhanden
ist. Zum Beispiel umfasst eine gegenwärtig bevorzugte Vorrichtung
ungefähr
einen Teil Bindemittel und ungefähr
5 Teile Matrix. Bestimmte andere bevorzugte Ausführungsformen umfassen ungefähr einen
Teil Bindemittel und ungefähr
10 Teile Matrix, während
noch andere ungefähr
einen Teil Bindemittel und ungefähr
25 Teile Matrix umfassen. Eine andere gegenwärtig bevorzugte Vorrichtung
umfasst ungefähr
3 Teile Bindemittel zu 5 Teilen Matrix. Bestimmte Bindemittel können relativ
zur Matrix in gleichen oder größeren Verhältnissen
verwendet werden. Eine andere, gegenwärtig bevorzugte Vorrichtung
umfasst 1 Teil Bindemittel und 3 Teile Matrix. Wie hierin beispielhaft
dargestellt, können
verbesserte Vorrichtungen von weitgehend divergierenden Verhältnissen
Knochen- und Knorpelbildung induzieren. Hierin beispielhaft dargestellt
sind verbesserte Vorrichtungen, welche Teile von Bindemittel zu
Teilen an Matrix aufweisen, die sich zwischen ungefähr 1:1 bis
4:1 sowie auch zwischen ungefähr
1:2 bis 1:5 und 1:10 bis 1:25 sowie auch 1:25 bis 1:50 bewegen.
Jedes Verhältnis
von Bindemittel zu Matrix kann verwendet werden, um die vorliegende
Erfindung auszuüben.
-
Darüber hinaus
zieht die vorliegende Erfindung in Erwägung, dass eine verbesserte
osteogene Vorrichtung mehr als ein Matrixmaterial in Kombination
umfassen kann. Die relativen Verhältnisse können variiert werden, um das
gewünschte
klinische Ergebnis zu erzielen, und können routinemäßig unter
Verwendung von normalem Fachwissen bestimmt werden. Eine gegenwärtig bevorzugte
Matrix ist Kollagen, insbesondere Rinderkollagen. Eine andere geeignete
Matrix ist entmineralisierter Knochen. Noch andere geeignete Matrizen sind
Hydroxyapatite (HAp) mit variierenden molaren Verhältnissen
an Calcium:Phosphat (Ca/P), Porosität und Kristallinität; bioaktive
Keramiken; und Calcium-Phosphat-Keramiken,
um nur einige zu nennen. Außerdem werden
hierin auch Mischungen der vorstehend erwähnten Komponenten in Erwägung gezogen,
in denen HAp/Tricalciumphosphat-Verhältnisse verändert sind. In einer besonders
bevorzugten Ausführungsform
ist die Matrix β-Tricalcium-Phosphat
(β-TCP).
-
In
einem anderen Aspekt stellt die vorliegende Erfindung Verwendungen
der hierin beschriebenen Vorrichtung zur Induktion von lokaler Knochen-
oder Knorpelbildung zur Reparatur von Knochen, Knorpel oder osteochondralen
Defekten bereit. Die vorliegenden Verwendungen werden als nützlich in
Erwägung
gezogen, die Bildung von mindestens endochondralem Knochen, intramenbranösem Knochen
und Gelenkknorpel zu induzieren. Wie hierin offenbart, schließen die
Verwendungen für
die Reparatur die Behandlung von sowohl geschlossenen als auch offenen
Defekten mit den vorstehend beschriebenen, verbesserten osteogenen
Vorrichtungen ein. Wie hierin gelehrt wird, können die Verwendungen der vorliegenden
Erfindung unter Verwendung der verbesserten Vorrichtungen, welche
ein ausreichendes Volumen aufweisen, um die Defekt-Stelle zu füllen, sowie
auch unter Verwendung von verbesserten Vorrichtungen, die das nicht
tun, ausgeübt
werden. Darüber hinaus
sind als ein Ergebnis dieser Erfindung die Ausführungsformen zur Förderung
der Knochen- und/oder Knorpel-Defektreparatur ohne die Notwendigkeit
eines operativen Eingriffs vorhanden. Das Vorhandensein solcher
Verwendungen hat Auswirkungen für
beeinträchtigte
Individuen wie zum Beispiel Diabetiker, Raucher, übergewichte
Personen und andere, deren allgemeine Gesundheit und beeinträchtigte
Blutzirkulation zu ihren Extremitäten gefährdet ist, wenn ein operativer
Eingriff benötigt
wird. Beispiele von Defekten umfassen, sind aber nicht darauf beschränkt, Defekte
von kritischer Größe, Defekte
von nicht-kritischer
Größe, Pseudoarthrose-Frakturen,
Frakturen, ostochondrale Defekte, chondrale Defekte und peridontale
Defekte.
-
In
einem anderen Aspekt stellt die vorliegende Erfindung einen Kit
für die
Ausübung
der vorstehend beschriebenen Verwendungen bereit. Wie hierin in
Erwägung
gezogen, umfasst eine Ausführungsform
eines Kits zur Induktion von lokaler Knochenbildung oder Knorpelbildung
eine verbesserte Vorrichtung, wobei das osteogene Protein und die
Matrix im gleichen Behälter
verpackt sind. In anderen Ausführungsformen
befinden sich das osteogene Protein, die Matrix und das Bindemittel
im gleichen Behälter.
In noch anderen Ausführungsformen
wird auch Benetzungsmittel bereitgestellt und wird getrennt von
den anderen Kit-Komponenten verpackt.
-
Da
die vorliegende Erfindung Praktikern verbesserte Materialien und
Verwendungen zur Knochen- und Knorpelreparatur bereitstellt, einschließlich Reparatur
von Gelenkknorpel, der in Säugergelenken
vorhanden ist, überwindet
sie Probleme, die normalerweise bei der Verwendung der Verfahren
und Vorrichtungen des Fachgebiets angetroffen werden. Zum Beispiel
kann die vorliegende Erfindung an der defekten Stelle eher die Bildung
von echtem Hyalinknorpel induzieren als von Faserknorpel. Funktionsfähiger Hyalinknorpel
bildet sich an der defekten Stelle an der gelenkbildenden Oberfläche von
Knochen und degeneriert nicht mit der Zeit zu Faserknorpel. Im Gegensatz
dazu resultieren Verfahren des Stands der Technik im Allgemeinen
schlussendlich in der Entwicklung von Faserknorpel an der defekten
Stelle. Im Unterschied zu Hyalinknorpel fehlt dem Faserknorpel die
physiologische Fähigkeit,
gelenkbildende Gelenke zu ihrer vollen Kapazität zurückzuführen. Wenn daher verbesserte
osteogene Vorrichtungen gemäß den vorliegenden
Verfahren verwendet werden, kann der Praktiker einen osteochondralen
oder einen chondralen Defekt in einem funktionsfähigen, gelenkbildenden Gelenk
im Wesentlichen wiederherstellen und die unerwünschte Bildung von Faserknorpel
vermeiden, wie sie für
Verfahren des Stands der Technik typisch sind. Wie hierin in Erwägung gezogen,
enthält
die Erfindung weiterhin allogene Ersatzmaterialien zur Reparatur
von nicht-vaskulärem Gewebe
in einem Skelettgelenk, welches in der Bildung von mechanisch und
funktionell brauchbaren Ersatzgeweben an einem Gelenk resultiert.
-
Zusammenfassend
können
die Verwendungen, Vorrichtungen und Kits der vorliegenden Erfindung verwendet
werden, um endochondrale oder intramembranöse Knochenbildung zur Reparatur
von Knochendefekten zu induzieren, die spontan nicht heilen, sowie
zur Förderung
und Erhöhung
der Rate und/oder Qualität der
Bildung neuer Knochen, insbesondere der Reparatur von Brüchen und
Fusionen, einschließlich
operativen Wirbelsäulenversteifungen.
Die Verwendungen, Vorrichtungen und Kits können auch die Reparatur von
osteochondralen und/oder subchondralen Defekten induzieren, d.h.
die Bildung von neuem Knochen und/oder des darüberliegenden Oberflächenknorpels
induzieren. Die vorliegende Erfindung ist besonders für die Verwendung
in der Reparatur von Defekten geeignet, die aus sich verschlechternden
oder degenerativen Erkrankungen resultieren, wie zum Beispiel Osteochondritis
dessicans, aber nicht darauf limitiert. Sie ist auch für die Verwendung
in Patienten besonders geeignet, die wiederholte rekonstruktive
Operationen benötigen,
sowie auch für
Krebspatienten. Andere Anwendungen umfassen, sind aber nicht darauf
beschränkt,
protethische Reparatur, operative Wirbelsäulenversteifung, Skoliose,
craniale/faciale Reparatur und massive Reparatur des allogenen Transplantats.
-
Kurze Beschreibung der
Zeichnungen
-
Die
vorhergehenden und andere Gegenstände und Merkmale der Erfindung
sowie auch die Erfindung selbst werden durch die folgende Beschreibung
vollständiger
verstanden werden, wenn sie gemeinsam mit den begleitenden graphischen
Darstellungen gelesen wird, in welchen:
-
1 ein
Diagramm ist, welches die kohäsiven
Eigenschaften von verschiedenen Anteilen (Gew./Gew.) des Bindemittels
zu Anteilen (Gew./Gew.) der Standard-OP-Vorrichtung darstellt.
-
2 ein
Diagramm ist, welches die Effekte von unterschiedlichen Volumina
an Benetzungsmittel auf die Integrität einer verbesserten osteogenen
Vorrichtung zeigt.
-
Genaue Beschreibung der
bevorzugten Ausführungsformen
-
Um
den Gegenstand der beanspruchten Erfindung klarer und präziser zu
beschreiben, sind die folgenden Definitionen dazu gedacht, eine
Anleitung für
die Bedeutung der spezifischen Begriffe bereitzustellen, die in
der folgenden geschriebenen Beschreibung und in den beigefügten Ansprüchen verwendet
werden.
-
„Knochenbildung" bedeutet die Bildung
von endochondralem Knochen oder die Bildung von intramembranärem Knochen.
In Menschen beginnt die Knochenbildung während der ersten 6-8 Wochen
der fötalen
Entwicklung. Vorläufer-Stammzellen mit mesenchymalem
Ursprung wandern zu vorbestimmten Stellen, wo sie entweder: (a)
sich verdichten, sich vermehren und in knochenbildende Zellen (Osteoblasten)
differenzieren, ein Prozess, der im Schädel beobachtet wird und als „intramembranäre Knochenbildung" bezeichnet wird,
oder (b) sich verdichten, sich vermehren und sich als Zwischenstufe
in knorpelbildende Zellen (Chondoblasten) differenzieren, welche
anschließend
durch knochenbildende Zellen ersetzt werden. Genauer gesagt differenzieren
sich mesenchymale Stammzellen in Chondrocyten. Die Chondrocyten
verkalken dann, machen Hypertrophie durch und werden durch neu gebildeten
Knochen ersetzt, der durch differenzierte Osteoblasten gebildet wird,
die jetzt an der Stelle vorhanden sind. Anschließend wird der mineralisierte
Knochen weitgehend umgebildet und wird danach durch ein Ossiculum
besetzt, welches mit funktionsfähigen
Knochenmarkselementen gefüllt
ist. Dieser Prozess wird in langen Knochen beobachtet und wird als „endochondrale
Knochenbildung" bezeichnet.
Im postfötalen
Leben besitzt der Knochen die Fähigkeit,
sich nach einer Verletzung selbst zu reparieren, indem der zelluläre Prozess
der embryonalen endochondralen Knochenentwicklung nachgeahmt wird.
Das heißt,
dass mesenchymale Vorläuferzellen
aus dem Knochenmark, Periosteum und Muskel zur Migration in die
Defekt-Stelle induziert werden können
und mit der vorstehend beschriebenen Ereigniskaskade beginnen können. Dort
akkumulieren sie, vermehren sich und differenzieren sich in Knorpel,
der dann anschließend
durch neu gebildeten Knochen ersetzt wird.
-
„Knochen" bezieht sich auf
verkalktes (mineralisiertes) Bindegewebe, das hauptsächlich eine
Zusammensetzung von abgelagertem Calcium und Phosphat in der Form
von Hydroxyapatit, Kollagen (hauptsächlich Typ I-Kollagen) und
Knochenzellen wie zum Beispiel Osteoblasten, Osteocyten und Osteoclasten
sowie auch Knochenmarksgewebe umfasst, welches das Innere von wahrem
endochondralen Knochen bildet. Knochengewebe unterscheidet sich
wesentlich von anderen Geweben, einschließlich Knorpelgewebe. Genauer
gesagt ist Knochengewebe vaskularisiertes Gewebe, zusammengesetzt
aus Zellen und einem biphasischen Medium, umfassend eine mineralisierte,
anorganische Komponente (hauptsächliche
Hydroxyapatit-Kristalle) und eine organische Komponente (hauptsächlich Typ
I-Kollagen). Glucosaminoglycane machen weniger als 2% dieser organischen
Komponente und weniger als 1% des biphasischen Mediums selbst oder
des Knochengewebes an sich aus. Darüber hinaus liegt das im Knochengewebe
vorhandene Kollagen, im Vergleich mit Knorpelgewebe, in einer hoch-organisierten,
parallelen Anordnung vor. Knochendefekte, ob aus degenerativen,
traumatischen oder krebsartigen Krankheitsursachen, stellen eine
beachtliche Herausforderung für
den wiederherstellenden Chirurgen dar. Besonders schwierig ist die
Rekonstruktion oder die Reparatur von Skeletteilen, welche einen
Teil eines Multi-Gewebskomplexes darstellen, wie er zum Beispiel
in Säugergelenken
vorkommt.
-
„Knorpelbildung" bedeutet die Bildung
von Bindegewebe, welches Chondrocyten eingebettet in ein extrazelluläres Netzwerk
enthält,
umfassend Kollagenfasern (hauptsächlich
Typ II-Kollagen, gemeinsam mit anderen weniger häufigen Arten wie zum Beispiel
die Typen IX und XI), verschiedene Proteoglycane, andere Proteine
und Wasser. „Gelenkknorpel" bezieht sich spezifisch
auf Hyalin- oder
Gelenkknorpel, ein nicht-vaskuläres,
nicht-mineralisiertes Gewebe, welches die gelenkbildenden Oberflächen der
Knochenteile in Gelenken bildet und die Bewegung der Gelenke ohne
direkten Knochen-an-Knochenkontakt ermöglicht und dadurch die Abnutzung
und Verletzung von gegenüberliegenden
Knochenoberflächen
verhindert. Normaler, gesunder Gelenkknorpel wird als „hyalin" bezeichnet, d.h.
er weist eine charakteristische Milchglas-Erscheinung auf. Unter physiologischen
Bedingungen ruht Gelenkknorpelgewebe auf der darunter liegenden,
mineralisierten Knochenoberfläche,
die als subchondraler Knochen bezeichnet wird und die hoch vaskularisierte
Ossikel enthält. Dieser
Gelenk- oder hyaline Knorpel, der am Ende von artikulären Knochen
gefunden wird, ist ein spezialisiertes, histologisch eindeutiges
Gewebe und ist für
die Verteilung des Belastungswiderstands gegen zusammendrückende Kräfte und
das reibungslose Gleiten verantwortlich, das ein Teil der Gelenkfunktion
ist. Gelenkknorpel hat wenig oder keine selbst-regenerative Eigenschaften.
Wenn der Gelenkknorpel gerissen ist oder seine Dicke verringert
ist oder sonst als eine Folge von Zeit, Erkrankung oder Trauma verletzt
ist, ist seine Fähigkeit, die
darunter liegende Knochenoberfläche
zu schützen,
somit beeinträchtigt.
In normalem Gelenkknorpel besteht ein Gleichgewicht zwischen Synthese
und Abbau des vorstehend beschriebenen, extrazellulären Netzwerks.
In Gewebe, das jedoch wiederholtem Trauma ausgesetzt ist, zum Beispiel
aufgrund von Reibung zwischen schlecht ausgerichteten Knochen, die
miteinander in Kontakt stehen, oder oder bei Gelenkerkrankungen,
die durch einen Nettoverlust des Gelenkknorpels gekennzeichnet sind,
z.B. Osteoarthritis, tritt ein Ungleichgewicht zwischen Synthese
und Degeneration auf.
-
Andere
Arten von Knorpel in Skelettgelenken schließen Faserknorpel und elastischen
Knorpel ein. Sekundäre
Knorpelgelenke werden durch Scheiben von Faserknorpel gebildet,
welche die Wirbel in der Wirbelsäule
verbinden. Im Faserknorpel ist das Mucopolysaccharid-Netzwerk mit
markanten Kollagenbündeln
durchwirkt und die Chondrocyten sind weiter gestreut als im hyalinen
Knorpel. Elastischer Knorpel enthält Kollagenfasern, die histologisch ähnlich zu
Elastinfasern sind. Dem Knorpelgewebe einschließlich Gelenkknorpel, im Gegensatz
zu anderen Bindegeweben, fehlen Blutgefäße, Nerven, Lymphgefäße und Basalmembran.
Knorpel ist aus Chondrocyten aufgebaut, die ein reichliches extrazelluläres Milieu
synthetisieren, das aus Wasser, Kollagenen, Proteoglycanen und nicht-kollagenösen Proteinen
und Lipiden besteht. Kollagen dient dazu, Proteoglycane einzufangen
und dem Gewebe Zugfestigkeit zu verleihen. Typ II-Kollagen ist im
Knorpelgewebe das vorherrschende Kollagen. Die Proteoglycane setzten
sich aus einer variierenden Zahl von Glycosaminoglycanketten, Keratinsulfat,
Chondroitinsulfat und/oder Dermatansulfat und N-gekoppelte und O-gekoppelte
Oligosaccharide zusammen, die kovalent an einen Proteinkern gebunden
sind.
-
Gelenk-
oder Hyalinknorpel können
von anderen Knorpelarten sowohl durch ihre Morphologie als auch durch
ihre Biochemie unterschieden werden. Bestimmte Kollagene wie zum
Beispiel die fibrösen
knorpeligen Gewebe, welche in Narbengewebe vorkommen, sind zum Beispiel
keloid und typisch für
narbenartiges Gewebe, d.h. zusammengesetzt aus Kapillaren und reichlich
vorhandenen, irregulären,
unorganisierten Bündeln
von Typ I- und Typ II-Kollagen. Im Gegensatz dazu ist Gelenkknorpel
morphologisch durch oberflächliche
im Vergleich zu mittlere im Vergleich zu tiefen Zonen gekennzeichnet,
welche eine charakteristische Abstufung der Merkmale von der Gewebeoberfläche zur
Basis des Gewebes, angrenzend an den Knochen, zeigen. In der oberflächlichen
Zone sind die Chondrocyten zum Beispiel flach gedrückt und
liegen parallel zur Oberfläche, eingebettet
in ein extrazelluläres
Netzwerk, welches tangential angeordnetes Kollagen und einige Proteoglycane
aufweist. In der mittleren Zone, sind die Chondrocyten sphärisch und
durch ein extrazelluläres
Netzwerk umrundet, das reich an Proteoglycanen und schräg organisiertem
Kollagenfasern ist. In der tiefen Zone, nahe dem Knochen, sind die
Kollagenfasern vertikal orientiert. Die Keratinsulfatreichen Proteoglycane
nehmen an Konzentration mit zunehmender Entfernung von der Knorpeloberfläche zu.
Für eine
genau Beschreibung der Gelenkknorpel-Mikrostruktur siehe zum Beispiel (Aydelotte
und Kuettner, (1988), Conn. Tiss. Res. 18:205; Zanetti et al., (1985),
J. Cell Biol. 101:53; und Poole et al., (1984), J. Anat. 138:13).
Biochemisch kann Gelenkkollagen durch die Anwesenheit von Typ II-
und Typ IX-Kollagen identifiziert werden, sowie durch die Anwesenheit
von gut charakterisierten Proteoglycanen und die Abwesenheit von
Typ X-Kollagen, welches mit der endochondralen Knochenbildung in
Zusammenhang steht.
-
Zwei
Defektarten werden in artikulären
Oberflächen
erkannt, d.h. Defekte über
die gesamte Dicke sowie oberflächliche
Defekte. Diese Defekte unterscheiden sich nicht nur im Ausmaß des physikalischen
Schaden des Knorpels, sondern auch in der Art der Reparaturreaktion,
die jede Art von Läsion
hervorrufen kann. Die Defekte über
die gesamte Dicke, die hierin auch als „osteochondrale Defekte" bezeichnet werden,
von einer gelenkbildenden Oberfläche
schließen
Schaden am Hyalinknorpel, der verkalkten Knorpelschicht und dem subchondralen
Knochengewebe mit seinen Blutgefäßen und
Knochenmark ein. Defekte über
die gesamte Dicke können
schwere Schmerzen verursachen, da die Knochenplatte sensorische
Nervenendigungen enthält. Solche
Defekte entstehen im Allgemeinen aus starkem Trauma und/oder während der
späten
Stadien degenerativer Knopelerkrankung wie zum Beispiel eine Osteoarthritis.
Defekte über
die gesamte Dicke können
gelegentlich zu Blutungen und der Induktion einer Reparaturreaktion
aus dem subchondralen Knochen führen. In
solchen Fällen
ist das gebildete Reparaturgewebe jedoch eine vaskularisierte, faserartige
Knorpelart mit ungenügenden
biomechanischen Eigenschaften und bleibt auf einer Langzeit—Basis nicht
bestehen. Im Gegensatz dazu sind oberflächliche Defekte im Gelenkknorpelgewebe
auf das Knorpelgewebe selbst beschränkt. Solche Defekte werden
hierin als „chondrale" oder „subchondrale
Defekte" bezeichnet
und sind berüchtigt,
da sie nicht heilen und keine Neigung zu Reparaturreaktionen zeigen.
Oberflächliche
Defekte können
als Fissuren, Risse oder Spalten in der Oberfläche des Knorpels auftreten.
Sie enthalten keine blutenden Gefäße (Blutflecken) wie jene,
die bei Defekten über
die gesamte Dicke beobachtet wurden. Oberflächliche Defekte müssen keinen
bekannten Grund haben, sie sind aber oft ein Resultat von mechanischen
Störungen,
die zu einer Abnützung
des Knorpelgewebes führen.
Solche mechanische Störungen
können
durch ein Gelenktrauma verursacht werden, z.B. eine Verlagerung
von gerissenem Meniskusgewebe in das Gelenk, Meniskusentfernung, Laxieren
des Gelenks durch ein gerissenes Band, schlechte Ausrichtung der
Gelenke oder Knochenfraktur oder durch Erbkrankheiten. Oberflächliche
Defekte sind auch für
die frühen
Stadien von degenerativen Gelenkerkrankungen wie zum Beispiel Osteoarthritis
kennzeichnend. Nachdem das Knorpelgewebe nicht innerviert oder vaskularisiert
ist, heilen oberflächliche
Defekte nicht und degenerieren oft in Defekte über die gesamte Dicke.
-
„Defekt” oder „Defekt-Stelle", wie hierin in Erwägung gezogen,
kann eine knöchrige,
strukturelle Unterbrechung definieren, die Reparatur erfordert.
Der Defekt kann ferner einen osteochondralen Defekt definieren,
einschließlich
einer strukturellen Unterbrechung von sowohl Knochen als auch darüberliegendem
Knorpel. Ein Defekt kann die Konfiguration eines „Hohlraums" annehmen, von welchem
klar ist, dass er einen dreidimensionalen Defekt wie zum Beispiel
eine Lücke,
Höhle,
ein Loch oder eine andere wesentliche Unterbrechung in der strukturellen
Integrität
eines Knochens oder Knorpels darstellt. Ein Defekt kann das Ergebnis
eines Unfalls, einer Erkrankung, operativen Manipulation und/oder
prothetischem Versagen sein. In gewissen Ausführungsformen ist der Defekt
ein Hohlraum, welcher ein Volumen hat, das nicht zu endogener oder
spontaner zu Reparatur im Stande ist. Solche Defekte haben im Allgemeinen
den doppelten Durchmesser des betrachteten Knochens und werden auch
als Defekte mit „kritischer
Größe" bezeichnet. Zum
Beispiel versteht man im Fachgebiet bei Defektmodellen der Ulna
von Hunden, dass solche Defekte ungefähr 3-4 cm groß sind, im
Allgemeinen mindestens 2,5 cm, eine Lücke, die nicht zu spontaner
Reparatur in der Lage ist. Siehe zum Beispiel Schmitz et al., Clinical
Orthopaedics und Related Research 205:299-308 (1986); und Vukicevic
et al., in Advances in Molecular and Cell Biology, Bd. 6, Seiten
207-224 (1993)(JAI Press, Inc.).
-
In
segmentalen Defektmodellen von Kaninchen und Affen ist die Lücke ungefähr 1,5 cm
bzw. 2,0 cm. In anderen Ausführungsformen
ist der Defekt ein segmentaler Defekt von nicht kritischer Größe. Im Allgemeinen
sind diese zu einer etwas spontanen Reparatur in der Lage, wenngleich
sie biochemisch minderwertig zu jenen sind, die durch Ausübung der
vorliegenden Innovation möglich
gemacht werden. In bestimmten anderen Ausführungsformen ist der Defekt
ein osteochondraler Defekt wie zum Beispiel ein osteochondraler
Pfropfen. Ein solcher Defekt durchquert die Gesamtheit des darüberliegenden
Knorpels und tritt, zumindest teilweise, in die darunterliegende
knochige Struktur ein. Im Gegensatz dazu durchquert ein chondraler
oder subchondraler Defekt den darüberliegenden Knorpel teilweise
bzw. im Ganzen, involviert aber den darunterliegenden Knochen nicht.
Andere Defekte, die unter Verwendung der vorliegenden Erfindung
für Reparatur
empfänglich
sind, schließen
Pseudoarthrose-Frakturen; Knochenkavitäten; Tumorresektion; frische
Frakturen (abgelenkt oder nicht abgelenkt); craniale/faciale Abnormalitäten; periodontale
Defekte und Unregelmäßigkeiten;
operative Wirbelsäulenversteifung;
sowie jene Defekte, die aus Krankheiten wie zum Beispiel Krebs,
Arthritis, einschließlich
Osteoarthritis, stammen, und andere degenerative Knochenerkrankungen
wie zum Beispiel Osteochondritis dessicans ein, sind aber nicht
auf sie beschränkt.
-
„Reparatur" soll neue Knochen-
und/oder Knorpelbildung bedeuten, die ausreichend ist, um den Hohlraum
oder die strukturelle Diskontinuität am Defekt zumindest teilweise
zu füllen.
Reparatur bedeutet jedoch nicht, oder benötigt andererseits nicht, einen
Prozess der vollkommenen Heilung oder eine Behandlung, die in der
Wiederherstellung eines Defektes zu dem physiologischen/strukturellen/mechanischen
Stadium vor dem Defekt 100% wirksam ist.
-
„Matrix", wie hierin in Erwägung gezogen,
bedeutet ein nicht-polymeres, nicht-synthetisches Material, welches als
osteokonduktives Substrat dienen kann und eine Gerüststruktur
aufweist, auf der sich infiltrierende Zellen anlagern, sich vermehren
und an den morphogenetischen Prozessen teilnehmen können, die
in der Knochenbildung gipfeln. Wie hierin in Erwägung gezogen, schließt Matrix
keine polymeren, synthetischen Materialien wie zum Beispiel polymere
Matrizen ein, umfassend Homopolymere oder Co-Polymere von α-Hydroxy-Essigsäure und/oder α-Hydroxy-Propionsäure, einschließlich racemischer
Gemische davon. Im Speziellen umfassen hierin in Erwägung gezogene
Matrizen keine Homopolymere oder Co-Polymere von Glykolsäure, Milchsäure und Buttersäure, einschließlich Derivaten
davon. Zum Beispiel kann die Matrix der vorliegenden Erfindung aus
biologischen oder aus der Natur stammenden oder natürlich vorkommenden
Materialien abgeleitet sein. Eine geeignete Matrix muss partikulär und porös sein,
wobei die Porosität
ein kritisches Merkmal für
ihre Wirksamkeit zur Induktion von Knochenbildung, insbesondere
endochondraler Knochenbildung, ist. Es ist selbstverständlich,
dass der Begriff „Matrix" eine strukturelle
Komponente oder ein Substrat bedeutet, welches intrinsisch eine
dreidimensionale Form aufweist, auf welcher bestimmte zelluläre Vorkommen
stattfinden werden, die an der endochondralen Knochenmorphogenese
beteiligt sind; eine Matrix wirkt als temporäre Gerüststruktur für infiltrierende
Zellen und weist Zwischenräume
zur Anlagerung, Vermehrung und Differenzierung solcher Zellen auf.
Die vorliegende Erfindung zieht in Erwägung, dass eine verbesserte osteogene
Vorrichtung mehr als ein Matrix-Material in Kombination umfassen
kann; die relativen Verhältnisse
können
variiert werden, um das gewünschte
klinische Ergebnis zu erzielen, und können routinemäßig durch
einen Fachmann bestimmt werden. Eine gegenwärtig bevorzugte Matrix ist
Kollagen, insbesondere Rinderkollagen. Eine andere geeignete Matrix
ist entmineralisierter Knochen. Noch weitere geeignete Matrizen
sind Hydroxyapaptite (HAp) von variierenden/r molaren Verhältnissen
an Calcium:Phosphat (Ca/P), Porosität und Kristallinität; bioaktive
Keramiken; und Calcium-Phosphat-Keramiken, um nur einige zu nennen.
Außerdem
werden hierin auch Mischungen der vorstehend erwähnten Komponenten in Erwägung gezogen,
wobei HAp/Tricalciumphosphat-Verhältnisse verändert sind. Diese Matrizen
können
im Handel in Form von Körnchen,
Blöcken
und Pudern erhalten werden. Zum Beispiel ist Pyrost
® ein
HAp-Block, stammend aus Rinderknochen (Osten AG, Schweiz); Collapta
® ist
ein HAp-Schwamm, der Kollagen enthält (Osten AG, Schweiz); Tricalcium-Phosphate (β-TCP) kann
von Pharma GmbH (Deutschland) als Cerasob
® erhalten
werden, sowie auch von Clarkson Chromatography Products, Inc. (S.
Williamsport, PA) oder Osteonics (Niederlande); TCP/HAp-Körnchen—Gemische
können
von Osteonics (Niederlande) erhalten werden; und 100% HAp-Pulver
oder -Körnchen
können von
CAM (einem Tochterunternehmen von Osteotech, NJ) erhalten werden.
Die Erzeugung und Charakterisierung von bestimmten der vorstehend
erwähnten
Matrizen sind im Fachgebiet ausführlich
beschrieben worden und benötigen
nicht mehr als Routineuntersuchungstechniken und durchschnittliches
Fachwissen. Siehe zum Beispiel
US
4,975,526 ;
US 5,011,691 ;
US 5,171,574 ;
US 5,266,683 ;
US 5,354,557 ; und
US 5,468,845 .
-
Andere
der vorstehend erwähnten
Matrizen sind im Fachgebiet auch gut beschrieben worden. Siehe zum
Beispiel Biomaterial-Abhandlungen wie zum Beispiel LeGeros und Daculsi
in Handbook of Bioactive Ceramics, II Seiten 17-28 (1990, CRC Press);
und andere veröffentlichte
Beschreibungen wie zum Beispiel Yang Cao, Jie Weng Biomaterials
17, (1996) Seiten 419-424; LeGeros, Adv. Dent. Res. 2, 164 (1988);
Johnson et al., J. Orthopaedic Research, 1996, Bd. 14, Seiten 351-369;
und Piattelli et al., Biomaterials 1996, Bd. 17, Seiten 1767-1770.
-
Gesintertes,
hoch gebranntes β-TCP
(β-Tricalcium-Phosphat)
ist eine gegenwärtig
bevorzugte Matrix. Gesintertes β-TCP
hat eine höhere
Auflösungsrate als
gesinterte HAps und gesintertes, biphasisches Calcium-Phosphat (BCP).
Die Fähigkeit
von β-TCP,
die Knochenbildung zu unterstützen,
scheint teilweise auf der Größe der Ca/P-Körnchen in
der Matrix zu beruhen. Gesintertes β-TCP, welches eine Partikelgröße von zwischen
212 μm und
etwa 425 μm
aufweist, wird am meisten bevorzugt und kann von Clarkson Chromatography Products,
Inc. (S. Williamsport, PA) oder Osteonics (Niederlande) erhalten
werden. Nach Implantierung zeigen Vorrichtungen, die Partikel in
der Größe innerhalb
dieses Bereichs aufweisen, durch Bildgebungsanalyse hohe Resorptionsraten
und niedrige entzündliche
Reaktionen, wenn sie bei einer subkutanen Stelle bei einer Ratte implantiert
werden, wie hierin anderswo beschrieben.
-
„Osteogene
Vorrichtung" bedeutet
selbstverständlich
eine Zusammensetzung, umfassend mindestens ein osteogenes Protein,
das in einer Matrix verteilt ist. Wie hierin offenbart, umfasst
eine „verbesserte
osteogene Vorrichtung" ein
osteogenes Protein, eine Matrix, wie hierin definiert, und ein Bindemittel,
wie vorstehend definiert. Im Gegensatz dazu umfasst eine „osteogene
Standardvorrichtung" ein
osteogenes Protein und eine Matrix, aber kein Bindemittel; osteogene
Standardvorrichtungen können
entweder eine synthetische, polymere oder eine wie vorstehend definierte
Matrix umfassen. In den Beispielen und Lehren, die nachstehend dargelegt werden,
sind osteogene Standardvorrichtungen ferner bezeichnet; Standardvorrichtungen,
OP-Vorrichtungen, OP-1-Vorrichtungen oder OP. Verbesserte osteogene
Vorrichtungen werden ferner bezeichnet: CMC-enthaltende Vorrichtung,
CMC-enthaltende
Standardvorrichtung, CMC/OP-1-Vorrichtung, OP-1/CMC/Kollagen, OPCMC/Kollagen
und Fibrinkleber enthaltende, verbesserte Vorrichtung. Wie hierin
verwendet, enthält
eine „Scheinvorrichtung" kein osteogenes
Protein und ist frei von jedem bekanntem osteoinduktivem Faktor
formuliert. Die vorliegende Erfindung zieht, wie hierin definiert,
auch verbesserte Vorrichtungen in Betracht, umfassend mindestens
zwei unterschiedliche osteogene Proteine und/oder mindestens zwei
unterschiedliche Matrizen, wie hierin definiert. Andere Ausführungsformen
der verbesserten Vorrichtungen können
weiters mindestens zwei unterschiedliche Bindemittel umfassen, wie
hierin definiert. In noch anderen Ausführungsformen kann, wie vorstehend
definiert, jede einzelne der vorstehend erwähnten, verbesserten Vorrichtungen
ferner ein Benetzungsmittel enthalten. Jede der vorstehend erwähnten Ausführungsformen
kann auch strahlenundurchlässige
Komponenten einschließen, wie
zum Beispiel im Handel erhältliche
Kontrastmittel. Im Allgemeinen gibt es drei gut bekannte Arten solcher
Mittel-Hydroxyapatite, Bariumsulfat und organisches Jodid. Vorrichtungen, die
strahlenundurchlässige
Komponenten enthalten sind, wie anderswo hierin besprochen wird,
für die
Verabreichung der Vorrichtung an einer geschlossenen Defekt-Stelle
besonders nützlich.
Identifizierung einer geeigneten strahlenundurchlässigen Komponente
benötigt
nur normales Fachwissen und Routineuntersuchungen. Siehe zum Beispiel
Radiografie-Abhandlungen einschließlich Ehrlich und McCloskey,
Patient Care in Radioqraphy (Mosby Publisher, 1993); Carol, Fuch's Radioqraphic Exposure,
Processing and Quality Control (Charles C. Thomas Herausgeber, 1993);
und Snopek, Fundamentals of Special Radioqraphic Procedures, (W.B. Saunders
Company, 1992).
-
Bevorzugte
Ausführungsformen
von verbesserten Vorrichtungen haften am Knochen, Knorpel, Muskel und/oder
an anderem Gewebe an. Sie haben verbesserte Handhabungseigenschaften
und sind resistent gegen Ablösung
während
der Spülung
während
Operation und während
des Zunähens.
Auf ähnliche
Weise sind sie kohäsiv
und werden nicht durch Spülung
und/der infiltrierende Körperflüssigkeiten
wie zum Beispiel Blut weggewaschen, abgelöst oder verdünnt. Bevorzugte
Ausführungsformen
bleiben sogar an einem gelenkbildenden Gelenk nach der Operation
haften. Von besonderer Bedeutung ist, dass verbesserte Vorrichtungen leicht
auf die defekten Stellen beschränkt
werden. Die verbesserte osteogene Vorrichtung der vorliegenden Erfindung
induziert funktionell beschleunigte Knochen- und/oder Knorpelbildung sowie stabilere
Gewebereparatur höherer
Qualität
und kann diese Vorteile bei Dosierungen von osteogenem Protein erzielen,
die niedriger sind als sie mit einer osteogener Standardvorrichtung
benötigt
werden. Die Vermischung von osteogenem Protein mit nicht-synthetischer,
nicht-polymerer Matrix und einem Bindemittel hat daher unerwartete
Eigenschaften, welche der geübte
Praktiker jetzt, wie hierin beispielhaft dargestellt, nützen kann.
Eine gegenwärtig
bevorzugte Ausführungsform
umfasst OP-1, Kollagenmatrix und das Bindemittel Carboxymethylcellulose
(CMC). Wie nachstehend besprochen wird, ist ein mit dem Bindemittel
CMC in Zusammenhang stehender Vorteil seine Effektivität, sogar
wenn es in relativ geringen Mengen vorhanden ist. Zum Beispiel kann
OP-1 in bestimmten, hierin beispielhaft dargestellten Ausführungsformen
in Mengen verwendet werden, die sich zwischen ungefähr 1,25
bis 2,50 mg pro ungefähr
1000 mg Kollagen und pro ungefähr
180 bis 200 mg CMC bewegen.
-
Diese
Matrizen und das Bindemittel, wie hierin beschrieben, zeigen alle
der vorstehend erwähnten,
bevorzugten Handhabungseigenschaften, die mit einer verbesserten
osteogenen Vorrichtung in Zusammenhang stehen.
-
In
bestimmten anderen Ausführungsformen
können
diese Mengen an Protein, Matrix und Bindemittel gemäß den mit
der Reparatur des Defekts in Zusammenhang stehenden Bedingungen
und Umständen
erhöht oder
vermindert werden. Ein Benetzungsmittel wie zum Beispiel Salzlösung kann
ferner hinzugefügt
werden. Wie nachstehend beispielhaft dargestellt, nimmt eine bevorzugte
Konfiguration für
die Implantation an einer offenen Defektstelle eine Konsistenz von
Kitt an. Sie kann durch den Chirurgen vor der Implantation modelliert und
geformt werden. Diese Konfiguration wird durch Einstellen der Verhältnisse
von Matrix zu Bindmittel zu Benetzungsmittel in einer Weise erzielt,
die ähnlich
jener ist, die hierin gelehrt wird. Wie weiter nachstehend beispielhaft
dargestellt, kann ein geschlossener Defekt mit einer lockereren,
flüssigeren
Konfiguration der Vorrichtung behandelt werden, welche ähnlich einer
viskosen Flüssigkeit
ist. Solche Konfigurationen können
ohne operativen Eingriff an der defekten Stelle injiziert werden.
Abermals kann bloßes
Einstellen der Verhältnisse von
Matrix zu Bindemittel zu Benetzungsmittel diese Ausführungsform
erzielen. Gegenwärtig
umfasst eine bevorzugte, verbesserte Vorrichtung ungefähr 1 Teil
Bindemittel (Gew./Gew.) zu ungefähr
5 Teilen Matrix (Gew./Gew.). Wie hierin nachstehend beschrieben,
können,
abhängig
von der Natur des Bindemittels und/oder der Matrix, andere Verhältnisse
verwendet werden, um verbesserte Vorrichtungen zu erzeugen.
-
Natürlich ist
es ein wesentliches Merkmal jeder Formulierung der verbesserten
osteogenen Vorrichtung, dass sie, sogar wenn transient angewendet,
in der Bereitstellung von mindestens einer lokalen Quelle an osteogenen
Protein an der defekten Stelle wirkungsvoll sein muss. Wie nachstehend
beispielhaft dargestellt, hat der Bindemittelgehalt einer verbesserten
osteogenen Vorrichtung keinen Einfluss auf die Proteinfreisetzungs-/Rückhaltekinetiken.
Das ist im Hinblick auf gegenteilige Beobachtungen überraschend,
dass nämlich
Polymer-enthaltende Standardvorrichtungen in der Abwesenheit von
Komplex bildendem Material (definiert, dass es Cellulosematerialien
beinhaltet) keine klinisch signifikanten osteoinduzierenden Wirkungen
zeigen konnten, da die Proteindesorption zu groß war (siehe zum Beispiel
US 5,597,897 ). Wie nachstehend
beispielhaft dargestellt, wird Protein von der verbesserten Vorrichtung
noch immer desorbiert, auch wenn ein wie hierin definiertes Bindemittel
vorhanden ist, allerdings sind die osteoinduktiven Effekte leicht
ersichtlich. Während
wir nicht durch Theorie gebunden sein möchten, scheinen die unerwarteten
Merkmale und Vorteile, die mit der vorliegenden Erfindung in Zusammenhang
stehen, weniger mit einer Protein-Bindemittel-Interaktion in Beziehung
zu stehen, sondern mehr mit einer Bindemittel-Matrix-Interaktion.
Speziell scheint das Bindemittel, wie es hierin definiert ist, die
durch die vorliegende Erfindung benötigte Matrix zu ergänzen und/oder
mit ihr synergistisch zu interagieren. Das ist vordem nicht wahrgenommen
worden und diese Kombination wird durch die Lehren des Stands der
Technik nicht empfohlen. (Siehe zum Beispiel
US 5,520,923 ; 5,597,897; und WO 95/24210).
-
Der
Begriff „einheitliche" Vorrichtung bezieht
sich auf eine dem Praktiker als eine einzelne, vorgemischte Formulierung
bereitgestellte, verbesserte osteogene Vorrichtung, umfassend osteogenes
Protein, Matrix und Bindemittel. Der Begriff „nicht-einheitliche" Vorrichtung bezieht
sich auf eine dem Praktiker als mindestens zwei getrennte Packungen
bereitgestellte, verbesserte osteogene Vorrichtung zum Zusammenmischen vor
der Verwendung. Üblicherweise
umfasst eine nicht-einheitliche
Vorrichtung mindestens ein Bindemittel, das getrennt von dem osteogenen
Protein und der Matrix verpackt ist. Der Begriff „Träger" bezieht sich auf
eine Beimischung von Bindemittel und Matrix, so wie jedes hierin
definiert ist. Demnach umfasst eine verbesserte osteogene Vorrichtung,
wie sie hierin offenbart ist, osteogenes Protein und einen Träger.
-
Zusätzlich zu
osteogenen Proteinen können
verschiedene Wachstumsfaktoren, Hormone, Enzyme, therapeutische
Zusammensetzungen, Antibiotika oder andere bioaktive Mittel auch
in einer verbesserten osteogenen Vorrichtung enthalten sein. Demnach
können
verschiedene, bekannte Wachstumsfaktoren wie zum Beispiel EGF, PDGF,
IGF, FGF, TGF-α und
TGF-β mit
einer verbesserten osteogenen Vorrichtung kombiniert werden und
an die Defekt-Stelle
verabreicht werden. Eine verbesserte osteogene Vorrichtung kann
auch verwendet werden, um chemotherapeutische Mittel, Insulin, Enzyme, Enzyminhibitoren
und/oder Chemo-Lockstoffe/chemotaktische Faktoren zu verabreichen.
-
Unter „osteogenem
Protein" oder Knochen-morphogenetischem-Protein
wird im Allgemeinen ein Protein verstanden, welches die volle Kaskade
an morphogenetischen Abläufen
induzieren kann, die in endochondraler Knochenbildung gipfeln. Wie
anderswo hierin beschrieben wird, ist die Klasse an Proteinen durch menschliches
osteogenes Protein (hOP-1) verkörpert.
Andere osteogene Proteine, die in der Anwendung der Erfindung nützlich sind,
umfassen osteogen aktive Formen von OP-1, OP-2, OP-3, BMP2, BMP3,
BMP4, BMP5, BMP6, BMP9, DPP, Vgl, Vgr, 60A-Protein, GDF-1, GDF-3,
GDF-5, 6, 7, BMP10, BMP11, BMP13, BMP15, UNIVIN, NODAL, SCREW, ADMP
oder NEURAL und Aminosäuresequenzvarianten
davon. In einer gegenwärtig
bevorzugten Ausführungsform
umfasst ein osteogenes Protein alle von: OP-1, OP-2, OP-3, BMP2,
BMP4, BMP5, BMP6, BMP9 und Aminosäuresequenzvarianten und Homologe
davon, einschließlich Arthomologe
davon. Besonders bevorzugte osteogene Proteine sind jene, welche
eine Aminosäuresequenz umfassen,
die mindestens 70% Homologie mit den C-terminalen 102-106 Aminosäuren aufweist,
welche die konservierte Sieben-Cystein-Domäne von menschlichem OP-1, BMP2
und verwandten Proteinen definieren. Bestimmte bevorzugte Ausführungsformen
der vorliegenden Erfindung umfassen das osteogene Protein OP-1.
Bestimmte andere, bevorzugte Ausführungsformen umfassen das reife
OP-1, solubilisiert in einer physiologischen Salzlösung. Wie
anderswo hierin weiter beschrieben, können die für die Verwendung mit der Erfindung
des Anmelders geeigneten osteogenen Proteine mittels Routineuntersuchungen
unter Verwendung eines im Fachgebiet anerkannten Biotests, beschrieben
durch Reddi und Sampath, identifiziert werden. Es wird hierin angenommen,
dass „Aminosäure-Sequenzhomologie" Aminosäure-Sequenzähnlichkeit
bedeutet. Homologe Sequenzen teilen identische oder ähnliche
Aminosäurereste,
wobei ähnliche
Reste konservative Austäusche
für, oder
erlaubte Punktmutationen von, entsprechenden Aminosäureresten
in einer ausgerichteten Referenzsequenz sind. Eine Kandidaten-Polypeptidsequenz,
die 70% Aminosäurehomologie
mit einer Referenzsequenz teilt, ist daher eine, in welcher irgendwelche
70% der ausgerichteten Reste entweder identisch sind zu, oder konservative
Substitutionen sind von, den entsprechenden Resten in einer Referenzsequenz. Beispiele
von konservierten Variationen schließen den Austausch von einem
hydrophoben Rest wie zum Beispiel Isoleucin, Valin, Leucin oder
Methionin ein, in einen anderen oder den Austausch eines polaren
Restes in einen anderen, wie zum Beispiel die Substitution von Arginin
für Lysin,
Glutamin- für
Asparaginsäure
oder Glutamin für
Asparagin und ähnliches,
ein. Der Begriff „konservative
Variation" schließt auch
die Verwendung einer substitutierten Aminosäure anstatt einer nicht-substitutierten
Eltern-Aminosäure
ein, vorausgesetzt dass Antikörper,
die gegen das substituierte Polypeptid erzeugt werden, auch mit
dem nicht-substituierten Polypeptid immunreagieren.
-
Proteine,
die in dieser Erfindung nützlich
sind, schließen
eukaryontische Proteine ein, die als osteogene Proteine identifiziert
wurden (siehe US Patent 5,011,691), wie zum Beispiel OP-1, OP-2,
OP-3 und CBMP-2-Proteine, sowie Aminosäuresequenz-verwandte Proteine
wie zum Beispiel DPP (aus Drosophila), Vgl (aus Xenopus), Vgr-1
(aus der Maus), GDF-1 (aus Menschen, siehe Lee (1991), PNAS 88:4250-4254), 60A
(aus Drosophila, siehe Wharton et al. (1991) PNAS 88:9214-9218),
Dorsalin-1 (aus Küken,
siehe Basler et al. (1993) Cell 73:687-702 und GenBank-Zugangsnummer
112032) und GDF-5 (aus der Maus, siehe Storm et al. (1994) Nature
368:639-643). BMP-3 ist auch bevorzugt. Zusätzliche nützliche Proteine umfassen biosynthetische
morphogenetische Konstrukte, offenbart in US-Pat. Nr. 5,011,691, z.B. COP-1, 3-5,
7 und 16 sowie auch andere, im Fachgebiet bekannte Proteine. Noch
weitere Proteine umfassen osteogen aktive Formen von BMP-3b (siehe
Takao, et al., (1996), Biochem. Biophys. Res. Comm. 219:656-662.
BMP-9 (siehe WO95/33830), BMP-15 (siehe WO96/35710), BMP-12 (siehe
WO95/16035), CDMP-1 (siehe WO 94/12814), CDMP-2 (siehe WO94/12814),
BMP-10 (siehe WO94/26893),
GDF-1 (siehe WO92/00382), GDF-10 (siehe WO95/10539), GDF-3 (siehe
WO94/15965) und GDF-7 (WO95/01802).
-
Noch
weitere nützliche
Proteine umfassen Proteine, die durch DNAs codiert werden, die im
Stande sind, mit einer DNA zu hybridisieren, die ein wie hierin
beschriebenes osteogenes Protein codieren, und verwandte Analoge,
Homologe, Muteine (biosynthetische Varianten) und ähnliches
(siehe nachstehend). Bestimmte Ausführungsformen der verbesserten
osteogenen Vorrichtungen, die hierin in Erwägung gezogen werden, umfassen
osteogenes Protein, das funktionsfähig und/oder stabil an Matrix
gebunden ist.
-
„Bindemittel” wie es
hierin verwendet wird, bedeutet jedes physiologischkompatible Material,
welches, wenn es mit osteogenem Protein und Matrix, wie hierin definiert,
gemischt wird, Knochen- und/oder Knorpelbildung fördert. Das
wie hierin beschriebene, bevorzugte Bindemittel fördert eine
solche Reparatur unter Verwendung von weniger osteogenem Protein
als in Standard-osteogenen Vorrichtungen. Das bevorzugte Bindemittel
kann unter Verwendung der gleichen Menge des osteogenen Proteins
wie die Standard-osteogenen Vorrichtungen Reparatur fördern, während manche
mehr benötigen,
um die Reparatur zu fördern.
Wie es hierin gelehrt wird, kann der Fachmann eine wirksame Menge
an Protein zur Verwendung mit jedem geeigneten Bindemittel unter
Verwendung von Routineuntersuchungen bestimmen. Unter den anderen
Eigenschaften des bevorzugten Bindemittels ist die Fähigkeit,
die Vorrichtung geschmeidig, formbar und/oder anpassungsfähig; injizierbar;
anhaftend an Knochen, Knorpel, Muskel und anderes Gewebe; resistent
gegen Zerfall nach Waschen und/oder Spülen während der Operation; und resistent
gegen Ablösung
während
der Operation, des Zunähens und
nach der Operation zu machen, um nur wenige zu nennen. Außerdem kann
ein Bindemittel in bestimmten bevorzugten Ausführungsformen die vorstehend
erwähnten
Merkmale und Vorteile erreichen, wenn es in geringen Anteilen vorhanden
ist. Zum Beispiel kann eine gegenwärtig bevorzugte, verbesserte
Vorrichtung ungefähr
1 Teil Bindemittel und ungefähr
5 Teile Matrix umfassen. Eine andere, gegenwärtig bevorzugte Vorrichtung
umfasst ungefähr
3 Teile Bindemittel zu 5 Teilen Matrix. Noch eine weiter bevorzugte
Vorrichtung umfasst ungefähr
1 Teil Bindemittel und ungefähr
10 Teile Matrix, während
andere ungefähr
1 Teil Bindemittel und ungefähr
25 oder 50 Teile Matrix umfassen. Bestimmte Bindemittel können in
gleichen oder größeren Verhältnissen
relativ zur Matrix verwendet werden, aber solche Mittel sollten,
wie hierin nachstehend gelehrt, getestet werden, um mögliche Matrix-Verdünnungseffekte
zu identifizieren.
-
Das
gemäß der Erfindung
verwendete Bindemittel ist Carboxymehtylcellulose, einschließlich des
Natriumsalzes davon, wobei das Bindemittel eine Viskosität von etwa
10-200 cP und einen Substitutionsgrad von 0,65-0,90 aufweist.
-
„Benetzungsmittel", wie hierin verwendet,
bedeutet jede physiologisch verträgliche wässrige Lösung, vorausgesetzt dass sie
nicht bei der Knochen- und/oder
Knorpelbildung stört.
In bestimmten Ausführungsformen
der vorliegenden Erfindung wird der verbesserten Vorrichtung ein
Benetzungsmittel beigemischt, um die Konsistenz zu erzielen, die
durch die Art der Defektreparatur benötigt wird. Wie hierin gelehrt,
kann das Benetzungsmittel verwendet werden, um eine Kitt-Konfiguration zu
erzielen, oder alternativ die Konfiguration einer viskosen Flüssigkeit.
Ein gegenwärtig
bevorzugtes Benetzungsmittel ist physiologische Salzlösung. Äquivalente
können
durch den Fachmann unter Verwendung von nicht mehr als Routineuntersuchungen
und normales Fachwissen identifiziert werden.
-
Die
Mittel zur Herstellung und Anwendung der Verwendungen, Implantate
und Vorrichtungen der Erfindung sowie auch andere Materialaspekte,
welche ihre Art und Nutzbarkeit betreffen, einschließlich wie
der beanspruchte Gegenstand hergestellt und wie er verwendet werden
soll, werden aus dem Folgenden weiter verstanden werden, das die
beste, gegenwärtig
in Erwägung
gezogenen Art der Anwendung der Erfindung darstellt. Es wird klar
sein, dass die Erfindung nicht auf solche beispielhafte Arbeit oder
auf die spezifischen Details beschränkt ist, die in diesen Beispielen
dargelegt werden.
-
I. PROTEINERWÄGUNGEN
-
A. Biochemische, strukturelle
und funktionelle Eigenschaften von morphogenetischen Knochenproteinen
-
Natürliche vorkommende
Proteine, die hierin als osteogene oder morphogenetische Knochenproteine identifiziert
und/oder bewertet wurden, bilden eine eindeutige Untergruppe innerhalb
der lockeren evolutionären
Gruppierung von sequenz-verwandten Proteinen, die als die TGF-β-Superfamilie
oder -Supergen-Familie bekannt
sind. Die natürlich
vorkommenden Knochen-Morphogene teilen eine wesentliche Aminosäure-Sequenzhomologie
in ihren C-terminalen Bereichen (Domänen). Üblicherweise werden die vorstehend
erwähnten,
natürlich
vorkommenden osteogenen Proteine als ein Vorläufer translatiert, welcher
eine N-terminale
Signalpeptidsequenz von üblicherweise
weniger als etwa 30 Resten aufweist, gefolgt von einer „Pro"-Domäne, welche
abgespalten wird, um die reife C-terminale
Domäne
zu ergeben. Das Signalpeptid wird nach der Translation rasch bei
einer Spaltstelle abgespalten, die in einer bestimmten Sequenz unter
Verwendung des Verfahrens von Von Heijne (1986) Nucleic Acids Research
14:4683-4691 vorhergesagt werden kann. Die Prodomäne ist üblicherweise
etwa dreimal größer als
die vollkommen prozessierte reife C-terminale Domäne.
-
In
bevorzugten Ausführungsformen
haben die Paare an morphogenetischen Polypeptiden Aminosäuresequenzen,
die jede eine Sequenz umfassen, welche eine definierte Beziehung
mit einer Aminosäuresequenz
eines Referenzmorphogens teilt. Hierin teilen bevorzugte osteogene
Polypeptide eine definierte Beziehung mit einer Sequenz, die in
osteogen aktivem menschlichem OP-1, SEQ ID NO: 2, vorhanden ist.
Es könnte jedoch
jede einzelne oder mehrere der natürlich vorkommenden oder biosynthetischen,
hierin offenbarten Sequenzen auf ähnliche Weise wie eine Referenzsequenz
verwendet werden. Bevorzugte osteogene Polypeptide teilen eine definierte
Beziehung mit mindestens der C-terminalen 6-Cystein-Domäne aus menschlichem OP-1,
Reste 335-431 der SEQ ID NO: 2. Vorzugsweise teilen osteogene Polypeptide
eine definierte Beziehung mit mindestens der C-terminalen 7-Cystein-Domäne von menschlichem
OP-1, Reste 330-431 von SEQ ID NO: 2. Das heißt, dass bevorzugte Polypeptide
in einem dimeren Protein mit morphogenetischer Knochenaktivität jeweils
eine Sequenz umfassen, die einer Referenzsequenz entspricht oder
funktionell dazu äquivalent
ist.
-
Funktionell äquivalente
Sequenzen schließen
funktionell äquivalente
Anordnungen von Cysteinresten ein, die innerhalb der Referenzsequenz
angeordnet sind, einschließlich
Aminosäure-Insertionen
oder -Deletionen, welche die lineare Anordnung von diesen Cysteinen ändern, aber
ihre Beziehung in der gefalteten Struktur des dimeren morphogenetischen
Proteins nicht erheblich behindern, einschließlich ihrer Fähigkeit,
solche intra- oder inter-Ketten-Disulfidbindungen zu bilden, die
für die
morphogenetische Aktivität
notwendig sein könnten.
Funktionell äquivalente
Sequenzen schließen
ferner jene ein, worin sich ein oder mehrere Aminosäurereste
von dem entsprechenden Rest einer Referenzsequenz unterscheiden,
z.B. die C-terminale 7 Cystein-Domäne (hierin auch als das konservierte
7-Cystein-Skelett bezeichnet) von menschlichem OP-1, vorausgesetzt
dass dieser Unterschied die morphogenetische Knochenaktivität nicht
zerstört.
Demgemäß werden konservative
Substitutionen von entsprechenden Aminosäuren in der Referenzsequenz
bevorzugt. Aminosäurereste,
die konservative Substitutionen für entsprechende Reste in einer
Referenzsequenz sind, sind jene, die physikalisch und funktionell ähnlich zu
dem entsprechenden Referenzrest sind, z.B. die ähnliche Größe, Form, elektrische Ladung,
chemische Eigenschaften, einschließlich der Fähigkeit aufweisen, kovalente
oder Wasserstoffbrücken
zu bilden, oder ähnliches.
Besonders bevorzugte konservative Substitutionen sind jene, welche die
Kriterien erfüllen,
die für
eine akzeptierte Punktmutation in Dayhoff et al., (1978), 5 Atlas
of Protein Sequence and Structure, Erg. 3, Kapitel 22 (Seiten 354-352),
Natl. Biomed. Res. Found., Washington, D.C. 20007, definiert sind.
-
Beispiele
konservativer Substitutionen umfassen: konservative Substitutionen,
die üblicherweise
die Substitutionen von einer Aminosäure für eine andere mit ähnlichen
Eigenschaften umfassen, z.B. Substitutionen innerhalb der folgenden
Gruppen: Valin, Glycin; Glycin, Alanin; Valin, Isoleucin, Leucin;
Asparaginsäure, Glutaminsäure; Asparagin,
Glutamin; Serin, Threonin; Lysin, Arginin; und Phenylalanin, Tyrosin.
Der Begriff „konservative
Variation" schließt auch
die Verwendung von substituierten Aminosäuren anstatt einer unsubstituierten
Eltern-Aminosäure ein,
vorausgesetzt dass Antikörper,
die gegen das substituierte Polypeptid erzeugt wurden, auch mit
dem nicht-substituierten Polypeptid immunreaktiv sind.
-
Aus
der Natur stammendes osteogenes Protein in seiner reifen, nativen
Form ist ein glycosyliertes Dimer, welches üblicherweise ein offensichtliches
Molekulargewicht von etwa 30-36 kDa aufweist, wie durch SDS-PAGE
bestimmt. Wenn es reduziert wird, ergibt das 30-kDa- Protein zwei
glycosylierte Peptiduntereinheiten, die offensichtliche Molekulargewichte
von etwa 16 kDa und 18 kDa aufweisen. Im reduzierten Zustand weist
das Protein keine nachweisbare osteogene Aktivität auf. Das nicht-glycosylierte
Protein, welches auch osteogene Aktivität aufweist, hat ein offensichtliches
Molekulargewicht von etwa 27 kDa. Wenn es reduziert wird, wird das
27-kDa-Protein zu zwei nicht-glycosylierten Polypeptiden, welche
Molekulargewichte von etwa 14 kDa bis 16 kDa aufweisen, die im Stande
sind, endochondrale Knochenbildung in Säugern zu induzieren. Wie vorstehend
beschrieben, umfassen besonders nützliche Sequenzen jene, welche
die C-terminalen
96- oder 102-Aminosäure-Sequenzen
von DPP (aus Drosophila), Vgl (aus Xenopus), Vgr-1 (aus der Maus),
der OP-1 und OP-2-Proteine, Proteine (siehe US-Pat. Nr. 5,011,691 und Oppermann et
al.,) sowie der Proteine, welche als BMP2, BMP3, BMP4 (siehe WO88/00205,
US-Patentnr. 5,013,649 und WO91/18098), BMP5 und BMP6 (siehe WO90/11366,
PCT/US90/01630), BMP8 und BMP9 bezeichnet werden, umfassen.
-
Andere
morphogenetische Proteine, die in der Anwendung der Erfindung nützlich sind,
umfassen morphogenetisch aktive Formen von OP-1, OP-2, OP-3, BMP2,
BMP3, BMP4, BMP5, BMP6, BMP9, GDF-5, GDF-6, GDF-7, DPP, Vgl, Vgr,
60A-Protein, GDF-1, GDF-3, GDF-5, GDF-6, GDF-7, BMP10, BMP11, BMP13, BMP15,
UNIVIN, NODAL, SCREW, ADMP, NEURAL und Aminosäure-Sequenzvarianten davon. In einer gegenwärtig bevorzugten
Ausführungsform
umfassen osteogene Proteine irgendeines von: OP-1, OP-2, OP-3, BMP2,
BMP4, BMP5, BMP6, BMP9 und Aminosäure-Sequenzvarianten und Homologe
davon, einschließlich Arthomologe
davon.
-
Veröffentlichung,
die diese Sequenzen sowie ihre chemischen und physikalischen Eigenschaften
offenbaren, umfassen:
- OP-1 und OP-2: U.S. 5,011,691, U.S.
5,266,683, Ozkaynak et al. (1990) EMBO J. 9: 2085-2093; OP-3; WO94/10203
(PCT US93/10520); BMP2, BMP3, MBP4; WO88/00205, Wozney et al. (1988)
Science 242; 1528-1534); BMP5 und BMP6: Celeste et al. (1991) PNAS
87: 9843-9847; Vgr-1: Lyons et al. (1989) PNAS 86: 4554-4558; DPP:
Padgett el al. (1987) Nature 325: 81-84; Vg-1 Weeks (1987) Cell
51: 861-867; BMP-9: WO95/33830 (PCT/US95/07084); BMP10: WO94/26893
(PCT/US94/05290); BMP-11: WO94/26892 (PCT/US94/05288); BPM12: WO95/16035
(PCT/US94/14030); BMP-13: WO95/16035 (PCT/US94/14030); GDF-1: WO92/00382
(PCT/US91/04096) und Lee et al (1991) PNAS 88: 4250-4254; GDF-8:
WO94/21681 (PCT/US94/03019); GDF-9; WO94/15966 (PCT/US94/00685);
GDF-10: WO95/10539 (PCT/US94/11440); GDF-11: WO96/01845 (PCT/US95/08543);
BMP-15: WO96/36710 (PCT/US96/06540); MP121: WO96/01316 (PCT/EP95/02552);
GDF-5 (CDMP-1, MP52); WO94/15949 (PCT/US94/00657) und WO96/14335 (PCT/US94/12814)
und WO93/16099 (PCT/EP93/00350); GDF-6 (CDMP-2, BMP13): WO95/01801 (PCT/US94/07762)
und WO96/14335 und WO95/10635 (PCT/US94/14030); GDF-7 (CDMP-3, BMP12); WO95/10802
(PCT/US94/07799) und WO95/10635 (PCT/US94/14030).
-
In
einer anderen Ausführungsform
umfassen nützliche
Proteine biologisch aktive, biosynthetische Konstrukte, einschließlich neuer,
biosynthetischer, morphogenetischer Proteine und chimärer Proteine,
die unter Verwendung von Sequenzen aus zwei oder mehreren bekannten
Morphogenen entworfen wurden.
-
Siehe
auch die biosynthetischen Konstrukte, die in US-Patentnr. 5,011,691
offenbart werden (z.B. COP-1, COP-3, COP-4, COP-5, COP-7 und COP-16).
-
In
bestimmten bevorzugten Ausführungsformen
schließen
die hierin nützlichen
morphogenetischen Knochenproteine jene ein, in welchen die Aminosäuresequenzen
eine Sequenz umfassen, welche mindestens 70% Aminosäure-Sequenzhomologie
oder „Ähnlichkeit" und vorzugsweise
80% Homologie oder Ähnlichkeit mit
einem morphogenetischen Referenzprotein teilt, das aus den vorhergehenden
natürlich
vorkommenden Proteinen ausgewählt
ist. Vorzugsweise ist das Referenzprotein menschliches OP-1 und
die Referenzsequenz davon ist die C-terminale 7-Cystein-Domäne, die
in osteogen aktiven Formen des menschlichen OP-1 vorhanden ist,
Reste 330-431 von SEQ ID NO: 2. In bestimmten Ausführungsformen
wird ein Polypeptid, von dem vermutet wird, dass es funktionell äquivalent
zu einem morphogenetischen Referenzpolypeptid ist, daran unter Verwendung
des Verfahrens von Needleman et al., (1970) J. Mol. Biol. 48:443-453
ausgerichtet, was bequem durch Computerprogramme wie zum Beispiel
dem Align-Programm (DNAstar, Inc.) umgesetzt wird. Wie vorstehend
erwähnt,
werden interne Lücken
und Aminosäure-Insertionen in der
Kandidatensequenz zum Zwecke der Berechnung der definierten Beziehung
ignoriert und herkömmlich
als ein Grad an Aminosäure-Sequenzhomologie
oder -Identität
zwischen den Kandidaten und Referenzsequenzen ausgedrückt. „Aminosäure-Sequenzhomologie" wird hierin so verstanden,
dass es sowohl Aminosäure-Sequenzidentität als auch
-Ähnlichkeit
einschließt.
Homologe Sequenzen teilen idente und/oder ähnliche Aminosäurereste,
wobei ähnliche
Reste konservative Substitutionen für, oder „erlaubte Punktmutationen" von, entsprechenden
Aminosäureresten
in einer ausgerichteten Referenzsequenz sind. Eine Kandidaten- Polypeptidsequenz,
die 70% Aminosäurehomologie
mit einer Referenzsequenz teilt, ist eine, in welcher irgendwelche
70% der ausgerichteten Reste entweder identisch sind zu, oder konservative
Substitutionen sind von, den entsprechenden Resten in einer Referenzsequenz.
In einer gegenwärtig
bevorzugten Ausführungsform
ist die Referenzsequenz OP-1. Die hierin nützlichen morphogenetischen
Knochenproteine schließen
demgemäß allele,
phylogenetische Gegenstücke und
andere Varianten der bevorzugten Referenzsequenz ein, egal ob natürlich vorkommend
oder biosynthetisch erzeugt (z.B. einschließlich „Muteine" oder „mutierte Proteine"), sowie neue Mitglieder
der allgemein morphogenetischen Familie von Proteinen, einschließlich jenen
die vorstehen dargelegt und identifiziert wurden. Bestimmte, besonders
bevorzugte morphogenetische Polypeptide teilen mindestens 60% Aminosäure-Identität mit der
bevorzugten Referenzsequenz von menschlichem OP-1, noch mehr bevorzugt mindestens 65% Aminosäure-Identität damit.
-
In
anderen bevorzugten Ausführungsformen
wird die Familie der morphogenetischen Knochenpolypeptide, die in
der vorliegenden Erfindung nützlich
sind, und Mitglieder davon durch eine generische Aminosäuresequenz
definiert. Zum Beispiel beinhalten die nachstehend offenbarte generische
Sequenz 7 (SEQ ID NO: 4) und generische Sequenz 8 (SEQ ID NO: 5)
die unter den bevorzugten, bis jetzt identifizierten Protein-Familienmitgliedern
geteilten Homologien, einschließlich
mindestens OP-1, OP-2, OP-3, CBMP-2A, CBMP-2B, BMP-3, 60A, DPP,
Vgl, BMP-5, BMP-6,
Vgr-1 und GDF-1. Die Aminosäuresequenzen
für diese
Proteine werden, wie vorstehend zusammengefasst, hierin und/oder
im Fachgebiet beschrieben. Die generischen Sequenzen umfassen sowohl
die durch diese Sequenzen geteilte Aminosäure-Identität in der C-terminalen Domäne, definiert
durch die 6- und 7-Cystein-Skelette
(generische Sequenzen 7 bzw. 8), sowie alternative Reste für die variablen
Positionen innerhalb der Sequenz. Die generischen Sequenzen stellen
ein geeignetes Cystein-Skelett bereit, wobei sich inter- oder intramolekulare
Disulfidbrücken
bilden können,
und sie enthalten bestimmte kritische Aminosäuren, welche die tertiäre Struktur
der gefalteten Proteine wahrscheinlich beeinflussen. Außerdem ermöglichen
die generischen Sequenzen ein zusätzliches Cystein an Position
36 (generische Sequenz 7) oder Position 41 (generische Sequenz 8)
und schließen
damit die morphogenetisch aktiven Sequenzen von OP-2 und OP-3 ein. Generische
Sequenz 7

wobei jedes Xaa unabhängig ausgewählt wird aus einer Gruppe von
einer oder mehreren spezifizierten Aminosäuren, definiert wie folgt: „R" bedeutet „Rest" und
Xaa bei
R2 = (Tyr or Lys); Xaa bei R3 = Val or Ile); Xaa bei R4 = (Ser.
Asp or Glu); Xaa bei R6 = (Arg, Gln, Ser, Lys or Ala); Xaa bei R7
= (Asp or Glu); Xaa bei R8 = (Leu, Val or Ile); Xaa bei R11 = (Gln,
Leu, Asp, His, Asn or Ser); Xaa bei R12 = (Asp, Arg, Asn od.Glu);
Xaa bei R13 = (Trp od.Ser); Xaa bei R14 = (Ile oder Val); Xaa bei
R15 = (Ile od.Val); Xaa bei R16 (Ala od. Ser); Xaa bei R18 = (Glu,
Gln, Leu, Lys, Pro od.Arg); Xaa bei R19 = (Gly od.Ser); Xaa bei
R20 = (Tyr od.Phe); Xaa bei R21 = (Ala, Ser, Asp, Met, His, Gln,
Leu od.Gly); Xaa bei R23 = (Tyr, Asn od.Phe); Xaa bei R26 = (Glu.,
His, Tyr, Asp, Gln, Ala od.Ser); Xaa bei R28 = (Glu, Lys, Asp, Gln
od.Ala); Xaa bei R30 = (Ala, Ser, Pro, Gln, Ile od.Asn); Xaa bei
R31 = (Phe, Leu od. Tyr); Xaa bei R33 = (Leu, Val od. Met); Xaa
bei R34 = (Asn, Asp, Ala, Thr od.Pro); Xaa bei R35 = (Ser, Asp,
Glu, Leu, Ala od. Lys); Xaa bei R36 = (Tyr, Cys, His, Ser od. Ile);
Xaa bei R37 = (Met, Phe, Gly od.Leu); Xaa bei R38 = (Asn, Ser od. Lys);
Xaa bei R39 = (Ala, Ser, Gly od. Pro); Xaa bei R40 = (Thr, Leu od.Ser);
Xaa bei R44 = (Ile Valod. Thr); Xaa bei R45 = (Val, Leu, Met od.Ile);
Xaa bei R46 = (Gln od.Arg); Xaa bei R47 = (Thr, Ala od.Ser); Xaa
bei R48 = (Leu od.Ile); Xaa bei R49 = (Val od.Met); Xaa bei R50
= (His, Asn od.Arg); Xaa bei R51 = (Phe, Leu, Asn, Ser, Ala od.
Val); Xaa bei R52 = (Ile, Met, Asn, Ala, Val, Gly od. Leu); Xaa
bei R 53 = (Asn, Lys, Ala, Glu, Gly od. Phe), Xaa bei R54 = (Pro,
Ser od.Val), Xaa bei R55 = (Glu, Asp, Asn, Gly, Val, Pro od. Lys);
Xaa bei R56 = (Thr, Ala Val, Lys, Asp, Tyr, Ser, Gly, Ile od.His);
Xaa bei R57 = (Val, Ala od.Ile); Xaa bei R58 = (Pro od.Asp); Xaa
bei R.59 = (Lys, Leu od.Glu); Xaa bei R60 = (Pro, Val od.Ala); Xaa
bei R63 = (Ala od.Val); Xaa bei R65 = (Thr, Ala od.Glu); Xaa bei
R66 = (Gln, Lys, Arg oder Glu); Xaa bei R67 = (Leu, Met od.Val);
Xaa bei R68 = (Asn, Ser, Asp od.Gly); Xaa bei R69 = (Ala, Pro od.
Ser); Xaa bei R70 = (Ile, Thr, Val od.Leu); Xaa bei R71 = (Ser, Ala
od.Pro); Xaa bei R72 = (Val Leu, Met od. Ile); Xaa bei R74 = (Tyr
od.Phe); Xaa bei R75 = (Phe, Tyr, Leu oder His); Xaa bei R76 = (Asp,
Asn od.Leu); Xaa bei R77 = (Asp, Glu, Asn, Arg od. Ser); Xaa bei
R78 = (Ser, Gln, Asn, Tyr od.Asp); Xaa bei R79 = (Ser, Asn, Asp,
Glu od.Lys); Xaa bei R80 = (Asn, Thr od.Lys), Xaa bei R82 = (Ile,
Val. od.Asn); Xaa bei R84 = (Lys od.Arg); Xaa bei R85 = (Lys, Asn,
Gln, His, Arg od.Val); Xaa bei R86 = (Tyr, Glu od.His); Xaa bei
R87 = (Arg, Gln, Glu od.Pro); Xaa bei R88 = (Asn, Glu, Trpod. Asp);
Xaa bei R90 = (Val, Thr, Ala od.Ile); Xaa bei R92 = (Arg, Lys, Val,
Asp, Gln od.Glu); Xaa bei R93 = (Ala, Gly, Glu od. Ser); Xaa bei
R95 = (Gly od.Ala); Xaa bei R97 = (His od.Arg).
-
Die
generische Sequenz 8 (SEQ ID NO: 5) schließt die gesamte generische Sequenz
7 ein und umfasst zusätzlich
die folgende Sequenz (SEQ ID NO: 8) an ihrem N-Terminus:
-
Beginnend
mit Rest 7 ist demgemäß jedes „Xaa" in der generischen
Sequenz 8 eine festgelegte Aminosäure, definiert wie für die generische
Sequenz 7, mit dem Unterschied, dass jede Nummer eines Restes, die
für die
generische Sequenz 7 beschrieben ist, in der generischen Sequenz
8 um fünf
verschoben ist. Daher bezieht sich „Xaa bei R 2 = (Tyr oder Lys)
in der generischen Sequenz 7 auf Xaa bei R 7 in der generischen Sequenz
8. Xaa bei R 2 = (Lys, Arg, Ala oder Gln); Xaa bei R 3 = (Lys, Arg
oder Met); Xaa bei R 4 = (His, Arg oder Gln) und Xaa bei R 5 = (Glu,
Ser, His, Gly, Arg, Pro, Thr oder Tyr) in der generischen Sequenz
8.
-
In
einer anderen Ausführungsform
schließen
nützliche
osteogene Proteine jene ein, die durch die generischen Sequenzen
9 und 10 definiert sind, definiert wie folgt.
-
Genau
gesagt sind die generischen Sequenzen 9 und 10 zusammengesetzte
Aminosäuresequenzen der
folgenden Proteine: menschliches OP-1, menschliches OP-2, menschliches
OP-3, menschliches BMP-2, menschliches BMP-3, menschliches BMP-4,
menschliches BMP-5, menschliches BMP-6, menschliches BMP-8, menschliches
BMP-9, menschliches BMP-10, menschliches BMP-11, Drosophila-60A,
Xenopus-Vg-1, Seeigel-UNIVIN, menschliches CDMP-1 (Maus-GDF-5), menschliches
CDMP-2 (Maus-GDF-6, menschliches BMP-13), menschliches CDMP-3 (Maus-GDF-7,
menschliches BMP-12), Maus-GDF-3, menschliches GDF-1, Maus-GDF-1,
Huhn-DORSALIN, dpp, Drosophila-SCREW, Maus-NODAL, Maus-GDF-8, menschliches GDF-8,
Maus-GDF-9, Maus-GDF-10, menschliches GDF-11, Maus-GDF-11, menschliches
BMP-15, und Ratten-BMP3b. Wie die generische Sequenz 7 beherbergt
die generische Sequenz 9 das C-terminale
6-Cystein-Skelett und wie die generische Sequenz 8 beherbergt die
generische Sequenz 10 das 7-Cystein-Skelett. Generische
Sequenz 9 (SEQ ID NO: 6)


wobei
jedes Xaa unabhängig
von einer Gruppe von einer oder mehreren festgelegten Aminosäuren ausgewählt wird,
definiert wie folgt: „R" bedeutet „Rest" und
Xaa bei
R1 (Phe, Leu od.Glu); Xaa bei R2 =
(Typ, Phe, His, Arg, Thr,
Lys, Gln, Val od.Glu); Xaa bei R3 = (Val, Ile, Leu od.Asp); Xaa
bei R4 = (Ser, Asp, Glu, Asn od.Phe); Xaa bei R 5 = (Phe od.Glu);
Xaa bei R 6 = (Arg, Gln, Lys, Ser, Glu, Ala od.Asn), Xaa bei R 7
= (Asp, Glu, Leu, Ala od.Gln); Xaa bei R 8 = (Leu, Val, Met, Ile
od.Phe); Xaa bei R 9 = (Gly, His od.Lys); Xaa bei R 10 = (Trp od.Met);
Xaa bei R 11 = (Gln, Leu, His, Glu, Asn, Asp, Ser od. Gly); Xaa
bei R 12 = (Asp, Asn, Ser, Lys, Arg, Glu oder His); Xaa bei R 13
= (Trp od. Ser), Xaa bei R 14 = (Ile od. Val); Xaa bei R 15 = (Ile
od.Val); Xaa bei R 16 = (Ala, Ser, Tyr od.Trp); Xaa bei R 18 = (Glu,
Lys, Gln, Met, Pro, Leu, Arg, His od. Lys); Xaa bei R 19 = (Gly,
Glu, Asp, Lys, Ser, Gln, Arg od. Phe); Xaa bei R 20 = (Tyr oder
Phe); Xaa bei R 21 = (Ala, Ser, Gly, Met, Gln, His, Glu, Asp, Leu,
Asn, Lys od.Thr); Xaa bei R 22 = (Ala od.Pro); Xaa bei R 23 = (Tyr,
Phe, Asn, Ala od.Agr); Xaa bei R 24 = (Tyr, His, Glu, Phe od.Arg);
Xaa bei R 26 = (Glu, Asp, Ala, Ser, Tyr, His, Lys, Arg, Gln od.
Gly); Xaa bei R 28 = (Glu, Asp, Leu, Val, Lys, Gly, Thr, Ala od.Gln);
Xaa bei R 30 = (Ala, Ser, Ile, Asn, Pro, Glu, Asp, Phe, Gln od.
Leu); Xaa bei R 31 = (Phe, Tyr, Leu, Asn, Gly od.Arg); Xaa bei R
32 = (Pro, Ser, Ala od.Val); Xaa bei R 33 = (Leu, Met, Glu, Phe
od. Val); Xaa bei R 34 = (Asn, Asp, Thr, Gly, Ala, Arg, Leu od. Pro);
Xaa bei R 35 = (Ser, Ala, Glu, Asp, Thr, Leu, Lys, Gln od. His);
Xaa bei R 36 = (Tyr, His, Cys, Ile, Arg, Asp, Asn, Lys, Ser, Glu
od.Gly); Xaa bei R 37 = Met, Leu, Phe, Val, Gly od. Tyr); Xaa bei
R 38 = (Asn, Glu, Thr, Pro, Lys, His, Gly, Met, Val od.Arg); Xaa
bei R 39 = (Ala, Ser, Gly, Pro od.Phe); Xaa bei R 40 = (Thr, Ser,
Leu, Pro, His od.Met); Xaa bei R 41 = (Asn, Lys, Val, Thr od. Gln);
Xaa bei R 42 = (His, Tyr od.Lys); Xaa bei R 43 = (Ala, Thr, Leu
od.Tyr); Xaa bei R 44 = (Ile, Thr, Val, Phe, Tyr, Met od.Pro); Xaa
bei R45 = (Val, Leu, Met, Ile od. His), Xaa bei R 46 = (Gln, Arg.
od.Thr); Xaa bei R 47 (Thr, Ser, Ala, Asn od.His); Xaa bei R 48
= (Leu, Asn od.Ile); Xaa bei R 49 = (Val, Met, Leu, Pro od.Ile);
Xaa bei R 50 = (His, Asn, Arg, Lys, Tyr od. Gln); Xaa bei R 51 =
(Phe, Leu, Ser, Asn, Met, Ala, Arg, Glu, Gly od. Gln); Xaa bei R52
= (Ile, Met, Leu, Val, Lys, Gln, Ala od. Tyr); Xaa bei R 53 = (Asn,
Phe, Lys, Glu, Asp, Ala, Gln, Gly, Leu od.Val); Xaa bei R 54 = (Pro,
Asn, Ser, Val od.Asp); Xaa bei R 55 = (Glu, Asp, Asn, Lys, Arg,
Ser, Gly Thr, Gln, Pro od. His); Xaa bei R 56 = (Thr.His, Tyr, Ala,
Ile, Lys, Asp, Ser, Gly od.Arg); Xaa bei R 57 = (Val, Ile, Thr,
Ala, Leuod. Ser); Xaa bei R 58 = (Pro, Gly, Ser, Asp od.Ala); Xaa
bei R 59 = (Lys, Leu, Pro, Ala, Ser, Glu, Arg od.Gly); Xaa bei R
60 = (Pro, Ala, Val, Thr od. Ser); Xaa bei R 61 = (Cys, Val od.
Ser), Xaa bei R 63 = (Ala, Val od.Thr); Xaa bei R 65 = (Thr, Ala,
Glu, Val, Gly, Asp oder Tyr); Xaa bei R 66 = (Gln, Lys, Glu, Arg
od.Val); Xaa bei R 67 (Leu, Met, Thr od. Tyr); Xaa bei R 68 = (Asn,
Ser. Gly, Thr, Asp, Glu, Lys od.Val); Xaa bei R 69 = (Ala, Pro,
Gly od. Ser); Xaa bei R 70 = (Ile, Thr, Leu od.Val); Xaa bei R 71
= (Ser, Pro, Ala, Thr, Asn od.Gly); Xaa bei R 72 = (Val, Ile, Leu
od.Met); Xaa bei R 74 = (Tyr, Phe, Arg, Thr, Tyr od.Met), Xaa bei
R 75 = (Phe, Tyr, His, Leu, Ile, Lys, Gln od.Val); Xaa heiR 76 = (Asp,
Leu, Asn od.Glu); Xaa bei R 77 = (Asp, Ser, Arg, Asn, Glu, Ala,
Lys, (Gly od. Pro); Xaa bei R 78 = (Ser, Asn, Asp, Tyr, Ala, Gly,
Gln, Met, Glu, Asn od.Lys); Xaa bei R 79 = (Ser, Asn, Gln, Asp,
Val, Lys, Gly, Gln od. Arg); Xaa bei R 80 = (Asn, Lys, Thr; Pro,
Val, Ile, Arg, Ser od.Gln); Xaa bei R 81 = (Val, Ile, Thr od.Ala);
Xaa bei R 82 = (Ile; Asn, Val, Leu, Tyr, Asp od.Ala); Xaa bei R
83 = (Leu, Tyr, Lys od.Ile); Xaa bei R 84 = (Lys, Arg, Asn, Tyr,
Phe, Thr, Glu od.Gly); Xaa bei R 85 = (Lys, Arg, His, Gln, Asn,
Glu od. Val); Xaa bei R 86 = (Tyr, His, Glu od.Ile); Xaa bei R 87
= (Arg, Glu, Gln, Pro od. Lys); Xaa bei R 88 = (Asn, Asp, Ala, Glu,
Gly od.Lys); Xaa bei R 89 = (Met od. Ala); Xaa bei R 90 = (Val,
Ile, Ala, Thr, Ser od. Lys); Xaa bei R 91 = (Val od. Ala); Xaa bei R
92 = (Arg, Lys, Gln, Asp, Glu, Val, Ala, Ser od. Thr); Xaa bei R
93 = (Ala, Ser, Glu, Gly, Arg oder Thr); Xaa bei R 95 = (Gly, Ala
od.Thr); Xaa bei R 97 = (His, Arg, Gly, Leu od.Ser).
-
Nach
Rest 53 in rBMP3b und mGDF-10 befindet sich ferner ein Ile; nach
Rest 54 in GDF-1 ist ein T; nach Rest 54 in BMP3 ist ein V; nach
Rest 78 in BMP-8 und Dorsalin ist ein G; nach Rest 37 in hGDF-1
ist ein Pro, Gly, Gly, Pro.
-
Die
generische Sequenz 10 (SEQ ID NO: 7) schließt die gesamte generische Sequenz
9 (SEQ ID NO: 6) ein und umfasst zusätzlich die folgende Sequenz
(SEQ ID NO: 9) an ihrem N-Terminus:
-
Beginnend
mit Rest 6 ist demgemäß jedes „Xaa" in der generischen
Sequenz 10 eine festgelegte Aminosäure, definiert wie für die generische
Sequenz 9, mit der Ausnahme, dass jede Nummer eines Restes, die für die generische
Sequenz 9 beschrieben wird, in der generischen Sequenz 10 um fünf verschoben
ist. Daher bezieht sich „Xaa
bei R 1 = (Tyr, Phe, His, Arg, Thr, Lys, Gln, Val oder Glu)" in der generischen
Sequenz 9 auf Xaa bei R 6, in der generischen Sequenz 10. Xaa bei
R 2 = (Lys, Arg, Gln, Ser, His, Glu, Ala oder Cys); Xaa bei R3 =
(Lys, Arg, Met, Lys, Thr, Leu, Tyr oder Ala); Xaa bei R 4 = (His,
Gln, Arg, Lys, Thr, Leu, Val, Pro oder Tyr); und Xaa bei R 5 = (Gln,
Thr, His, Arg, Pro, Ser, Ala, Gln, Asn, Tyr, Lys, Asp oder Leu)
in der generischen Sequenz 10.
-
Wie
vorstehend erwähnt,
weisen bestimmte, gegenwärtig
bevorzugte morphogenetische Knochen-Polypeptidsequenzen, die in
dieser Erfindung nützlich
sind, mehr als 60% Identität
auf, vorzugsweise mehr als 65% Identität, mit der Aminosäuresequenz,
welche die bevorzugte Referenzsequenz von hOP-1 definiert. Diese
besonders bevorzugten Sequenzen umfassen allelische und phylogenetische
Gegenstück-Varianten
der OP-1- und OP-2-Proteine, einschließlich des Drosophila-60A-Proteins. Demgemäß schließen in bestimmten,
besonders bevorzugten Ausführungsformen
nützliche
morphogenetische Proteine aktive Proteine ein, umfassend Paare von
Polypeptidketten innerhalb der generischen Aminosäuresequenz,
die hierin als „OPX" (SEQ ID NO: 3) bezeichnet
wird, welche das 7-Cystein-Skelett definiert und die Homologien
zwischen mehreren identifizierten Varianten von OP-1 und OP-2 beherbergt.
Wie darin beschrieben, wird jedes Xaa an einer bestimmten Position
unabhängig
von den Resten ausgewählt,
die an der entsprechenden Position in der C-terminalen Sequenz der
Maus oder des menschlichen OP-1 oder OP-2 vorkommt.

wobei
Xaa bei R2 = (Lys od.Arg); Xaa bei R3 = (Lys od.Arg); Xaa bei R11
= (Arg od.Gln); Xaa bei R16 = (Gln od.Leu); Xaa bei R19 = (Ile od.Val);
Xaa bei R23 = (Glu od.Gln); Xaa bei R26 = (Ala od.Ser); Xaa bei
R35 = (Ala od.Ser); Xaa bei R39 = (Asn od.Asp); Xaa bei R41 = (Tyr
od.Cys); Xaa bei R50 = (Val od.Leu); Xaa bei R52 = (Ser od.Thr);
Xaa bei R56 = (Phe od.Leu); Xaa bei R57 = (Ile od.Met); Xaa bei
R58 = (Asn od.Lys); Xaa bei R60 = (Glu, Asp od. Asn); Xaa bei R61
= (Thr, Ala od.Val); Xaa bei R65 = (Pro od.Ala); Xaa bei R71 = (Gln od.
Lys); Xaa bei R73 = (Asn od.Ser); Xaa bei R75 = (Ile od.Thr); Xaa
bei R80 = (Phe oder Tyr); Xaa bei R82 = (Asp od. Ser); Xaa bei R84
= (Ser od. Asn); Xaa bei R89 = (Lys od. Agr); Xaa bei R91 = (Tyr
od.His); und Xaa bei R97 = (Arg od. Lys).
-
In
noch einer weiteren bevorzugten Ausführungsform weisen nützliche,
osteogen aktive Proteine Polypeptidketten mit Aminosäuresequenzen
auf, die eine durch eine Nucleinsäure codierte Sequenz umfassen, welche
unter niedrig, mittel oder hoch stringenten Hybridisierungsbedingungen
an DNA oder RNA hybridisiert, die morphogenetische Referenzsequenzen
codiert, z.B. C-terminale Sequenzen, welche die konservierten 7-Cystein-Domänen von
OP-1, OP-2, BMP2, 4, 5, 6, 60A, GDF3, GDF6, GDF7 und ähnlichen
codieren. Wie hierin verwendet, sind hochstringente Hybridisierungsbedingungen
definiert als Hybridisierung gemäß bekannten
Techniken in 40% Formamid, 5 X SSPE, 5 X Denhard-Lösung und
0,1% SDS bei 37°C über Nacht und
Waschen in 0,1 X SSPE, 0,1% SDS bei 50°C. Stringente Standardbedingungen
sind in im Handel erhältlichen,
molekularen Clonierungstexten Standard gut charakterisiert. Siehe
zum Beispiel Molecular Cloning A Laborstory Manual, 2. Aufl., hrsg.
durch Sambrook, Fritsch und Maniatis (Cold Spring Harbor Laborstory
Press: 1989); DNA Cloning, Bände
I und II (D.N. Glover Hrsg. 1985); Oligonucleotide Synthesis (M.J.
Gait, Hrsg. 1984); Nucleic Acid Hybridization (B.D.
-
Hames & S.J. Higgins
Hrsg. 1984); und B. Perbal, A Practical Guide to Molecular Cloning
(1984).
-
Wie
vorstehend erwähnt,
sind in der vorliegenden Erfindung nützliche Proteine im Allgemeinen
dimere Proteine, umfassend ein gefaltetes Paar der vorstehenden
Polypeptide. Solche morphogenetischen Proteine sind inaktiv, wenn
sie reduziert sind, aber sind als oxidierte Homodimere aktiv und
wenn sie in Kombination mit anderen dieser Erfindung oxidiert werden,
um Heterodimere zu bilden. Die Mitglieder eines gefalteten Paares an
morphogenetischen Polypeptiden in einem morphogenetisch aktiven
Protein können
unabhängig
aus jedem der vorstehend erwähnten,
spezifischen Polypeptide ausgewählt
werden.
-
Die
morphogenetischen Knochenproteine, die in den Materialien und Verfahren
der Erfindung nützlich sind,
schließen
Proteine ein, die jede der vorstehend beschriebenen Polypeptidketten
umfassen, egal ob sie aus natürlich
vorkommenden Quellen isoliert werden oder durch rekombinante DNA
oder andere synthetische Techniken isoliert werden, und umfassen
allelische und phylogenetische Gegenstück-Varianten dieser Proteine
sowie auch Muteine davon und verschiedene verkürzte und Fusionskonstrukte.
Von Deletions- und Additonsmutaten wird auch angenommen, dass sie
aktiv sind, einschließlich
jener, welche die konservierte C-terminale 6- oder 7-Cystein-Domäne verändern können, vorausgesetzt
dass diese Änderung
die Beziehung dieser Cysteine in der gefalteten Struktur nicht funktionell
stört.
Demgemäß werden
solche aktiven Formen als die Äquivalente
der spezifisch beschriebenen, hierin offenbarten Konstrukte angesehen.
Die Proteine können
Formen, welche unterschiedliche Glycosylierungsmuster aufweisen,
verschiedene N-Termini, eine Familie von verwandten Proteinen, die
Bereiche von Aminosäure-Sequenzhomologie
aufweisen, und aktive verkürzte
oder mutierte Formen von nativen oder biosynthetischen Proteinen,
erzeugt durch Expression von rekombinanter DNA in Wirtszellen, einschließen.
-
Die
hierin in Erwägung
gezogenen morphogenetischen Knochenproteine können aus intakter oder verkürzter cDNA
oder aus synthetischen DNAs in prokaryontischen oder eukaryontischen
Wirtszellen exprimiert und gereinigt, gespalten, wieder gefaltet
und dimerisiert werden, um morphogenetisch aktive Zusammensetzungen
zu erzeugen. Gegenwärtig
bevorzugte Wirtszellen umfassen, ohne Limitierung, Prokaryonten
einschließlich
E. coli oder Eukaryonten einschließlich Hefe oder Säugerzellen
wie zum Beispiel CHO-, COS- oder BSC-Zellen. Einem Fachmann wird
klar sein, dass andere Wirtszellen vorteilhaft verwendet werden
können. Genaue
Beschreibungen der morphogenetischen Knochenproteine, die bei der
Anwendung dieser Erfindung nützlich
sind, einschließlich
wie sie für
osteogene Aktivität
erzeugt, verwendet und getestet werden, sind in zahlreichen Veröffentlichungen
offenbart, einschließlich
US-Patentnr. 5,266,683 und 5,011,691.
-
Im
Lichte dieser Offenbarung und des im Fachgebiet vorliegenden Wissens
können
Gentechnikfachleute daher Gene aus cDNA- oder genomischen Genbanken
von verschiedenen, unterschiedlichen, biologischen Arten welche
die geeigneten Aminosäuresequenzen
codieren, oder von Oligonucleotiden isolieren, und können sie
dann in verschiedenen Arten von Wirtszellen, einschließlich sowohl
Prokaryonten als auch Eukaryonten, exprimieren, um große Mengen
an aktiven Proteinen zu erzeugen, die im Stande sind, endochondrale Knochenmorphogenese
in Säugern
zu stimulieren.
-
II. BINDEMITTEL-ERWÄGUNGEN
-
Wie
schon erklärt,
bedeutet „Bindemittel", wie es hierin verwendet
wird, jedes physiologisch verträgliche
Material, ausgewählt
aus der Gruppe, bestehend aus Carboxymethylcellulose und einem Natriumsalz
davon, wobei das Bindemittel eine Viskosität von etwa 10-200 cP und einen
Substitutionsgrad von 0.65-0,90 aufweist, wobei es, wenn es mit
dem osteogenen Protein und der Matrix, wie hierin definiert, gemischt
wird, Knochen- und/oder Knorpelbildung fördert. In gewissen, gegenwärtig bevorzugten
Ausführungsformen
fördert
das Bindemittel eine solche Reparatur unter Verwendung von weniger
osteogenem Protein als in osteogenen Standard-Vorrichtungen. Unter den anderen Eigenschaften
des bevorzugten Bindemittels, wie es hierin beschrieben wird, ist
die Fähigkeit
die Vorrichtung:
geschmeidig, formbar und/oder anpassungsfähig; injizierbar;
anlagerungsfähig
an Knochen, Knorpel, Muskel und andere Gewebe; resistent gegen Zerfall
nach Waschen und/oder Spülen
während
der Operation und resistent gegen Entfernung während der Operation, dem Zunähen und
nach der Operation, zu machen, um nur einige zu nennen. Außerdem kann
das Bindemittel in einer gegenwärtig
bevorzugten Ausführungsform
die vorstehend erwähnten
Merkmale und Vorteile erzielen, wenn es in relativ geringen Verhältnissen
vorhanden ist. Zum Beispiel umfasst eine gegenwärtig bevorzugte, verbesserte
Vorrichtung ungefähr
1 Teil Bindemittel und ungefähr
5 Teile Matrix. Eine andere, gegenwärtig bevorzugte Ausführungsform
umfasst 1 Teil Bindemittel und 3 Teile Matrix. Wie hierin beispielhaft
dargestellt, können
verbesserte Vorrichtungen von sehr divergenten Verhältnissen
Knochen- und Knorpelbildung induzieren. Hierin beispielhaft dargestellt
sind verbesserte Vorrichtungen, welche Teile von Bindemittel zu
Teilen an Matrix aufweisen, die sich zwischen ungefähr 1:1 bis
4:1 bis zu und einschließlich
mindestens 1:10 bewegen, sowie auch von ungefähr 1:2 bis 1:5 bis zu und einschließlich mindestens
1:10 und ferner einschließlich
1:25 bis 1:50. Jedes Verhältnis
von Bindemittel zu Matrix kann verwendet werden, um die vorliegende
Erfindung auszuüben.
Alle was benötigt
wird, ist Vermischen des Bindemittels mit der Matrix und dem osteogenen
Protein, um auf diese Weise Knochen- und Knorpelbildung zu erzielen.
Wie nachstehend besprochen, kann das Bindemittel in gleichen oder
größeren Verhältnissen
relativ zur Matrix verwendet werden, aber solche Mittel sollten,
wie hierin gelehrt, überprüft werden,
um jedwede Matrix-Verdünnungseffekte
zu messen.
-
Jene
Bindemittel, die hierin als nützlich
in Erwägung
gezogen werden, werden aus der Gruppe ausgewählt, bestehend aus Carboxymethylcellulose
und einem Natriumsalz davon, wobei, wie nachstehend beispielhaft
dargestellt und beschrieben, das Bindemittel eine Viskosität von etwa
10-200 cP und einen Substitutionsgrad von 0,65-0,90 aufweist, andere
Bindemittel schließen
Dextran, Mannit, weißes
Petrolatum, Sesamöl und
Beimischungen davon ein, sind aber nicht auf sie beschränkt.
-
Schließlich ist
ein anderes, hierin beschriebenes Bindemittel Fibrinkleber, welcher
ein Gemisch aus Säugerfibrinogen
und Thrombin enthält.
Wie nachstehend hierin beispielhaft dargestellt, kann der Fibrinkleber weite
Variationsbreiten an Fibrinogen und Thrombin umfassen, zum Beispiel
1 Teil Fibrinkleber und 25 Teile β-TCP-Matrix, der Thrombingehalt
kann von etwa 2.0 E bis 25 E, 5E bis 10 E und etwa 2,5 E bis 5 E
reichen.
-
Der
Fibrinogengehalt kann zum Beispiel von etwa 40 mg pro 1000 mg β-TCP reichen.
In einer Kollagen-enthaltenden, verbesserten Vorrichtung kann der
Fibrinogengehalt zum Beispiel von etwa 20 mg pro 1000 mg Kollagen
bis etwa 180 mg pro 1000 mg Kollagen reichen.
-
Im
Hinblick auf die hierin dargelegten Lehren kann der Fachmann, lediglich
durch Routineuntersuchungen und normales Fachwissen, geeignete Äquivalente
der vorstehend identifizierten Bindemittel identifizieren. Geeignete
Bindemittelkandidaten können,
wie nachstehend dargelegt, identifiziert, charakterisiert, getestet
und dann in osteogenen Vorrichtungen verwendet werden.
-
Der
Fachmann kann daher demgemäß Bindemittelkandidaten
identifizieren und kann auf ähnliche Weise Äquivalente
der bevorzugten Bindemittel, die hierin spezifisch identifiziert
wurden, nur unter Verwendung von normalem Fachwissen und Routineuntersuchungen
erkennen. Nach Identifizierung von (einem) geeigneten Kandidaten
kann der Fachmann die nachstehend dargelegten Richtlinien befolgen,
um zu einer endgültigen
Auswahl eines bevorzugten Bindemittels zu gelangen.
-
Basierend
auf Studien, ähnlich
jenen, die hierin beschrieben werden, sind Beispiele geeigneter
Bindemittel, aber nicht auf sie limitiert: Mannit/Dextran-Kombination; Dextran
alleine, Kombination aus Mannit/weißem Petrolatum; und Sesamöl. Eine
Mannit/Dextran-enthaltende, verbesserte Vorrichtung wurde wie folgt
formuliert: Ein Teil Dextran 40, 3 Teile Mannit, 1 Teil OP-Vorrichtung.
Solche verbesserte Vorrichtungen wurden mit 2,5 mg osteogenem Protein
pro g Kollagen oder pro 0,5 g Kollagen formuliert, dadurch wurde
die Dosis an osteogenem Protein variiert. Zur Verwendung in dem
vorliegenden Verfahren wurde die Rezeptur mit ungefähr 0,8 ml
Salzlösung
pro 2,5 g Mannit/Dextran-enthaltender Vorrichtung benetzt. Als nächstes wurde
eine Vorrichtung, die Dextran alleine enthielt, aus entweder 4 Teilen
Dextran oder 1 Teil Dextran zu 1 Teil OP-Vorrichtung formuliert
und mit ungefähr
0,8 ml Salzlösung
pro 2,0 g Vorrichtung benetzt. Dextran kann innerhalb eines MG von
3.000 bis 40.000 variieren. Als Nächstes wurde eine Mannitol/weißes Petrolatum-Vorrichtung
aus 1,5 Teilen Mannitol, 1,5 Teilen Petrolatum und 1 Teil OP-Vorrichtung
formuliert. Diese Formulierung benötigt keine Benetzung. Schließlich wurde
eine Sesamöl-enthaltende,
verbesserte Vorrichtung aus 1 Teil 01 und 1 Teil OP-Vorrichtung
gestaltet. Diese Rezeptur benötigt
keine Benetzung. Die vorstehend beschriebenen, verbesserten Vorrichtungen
verdeutlichen die Auswahl an: spezifischen Bindemitteln, Verhältnissen
in verbesserten Vorrichtungen und Volumina an Benetzungsmittel,
die in den verbesserten Vorrichtungen der vorliegenden Erfindung
verwendet werden können.
Die Chemie, Verhältnisse
und Benetzungsanforderungen werden variiert, sind jedoch alle innerhalb
des Fachkönnens
des Stands der Technik. Jede der vorstehend erwähnten, verbesserten Vorrichtungen
induzierte Knochenbildung (wie durch Calciumgehalt und % Knochen
gemessen), wenn sie in dem hierin beschriebenen subkutanem Rattentest
gemessen wurde.
-
A. CMC als ein Bindemittel
-
Wie
hierin gelehrt, ist Carboxymethylcellulose (CMC) das bevorzugte
Bindemittel. CMC ist im Handel von Lieferanten wie: Hercules Inc.,
Aqualon®Division,
Delaware; FMC Corporation, Pennsylvania; Britisch Celanese, Ltd.,
Vereinigtes Königreich;
und Henkel KGaA, Vereinigtes Königreich,
erhältlich,
aber nicht auf sie beschränkt.
Carboxymethylcellulose-Natrium ist das Natriumsalz eines Polycarboxymethylethers
von Cellulose mit einem typischen Molekulargewicht, das von 90.000-700.000
reicht. CMC wurde teilweise aufgrund der folgenden Punkte als ein
Kandidaten-Bindemittel identifiziert: CMC wird in oralen und topischen
pharmazeutischen Formulierungen häufig als ein Viskositäts-erhöhendes Mittel
verwendet. CMC wird auch in Kosmetika, Toilettenartikel und Nahrungsmittel
als ein emulgierendes Mittel (0,25-1,0%), Gel-bildendes Mittel (4,0-6,0%), injizierbares
Mittel (0,05%-0,75%) und als Tablettenbinder (1,0-6,0%) verwendet.
-
Während die
vorhergehenden Eigenschaften auf die Eignung als ein Bindemittel
hindeuten, bestätigten
die nachstehenden Experimente, dass CMC zur Verwendung in den hierin
offenbarten, verbesserten osteogenen Vorrichtungen geeignet war.
Solche bestätigenden
Experimente waren nötig,
da keine der vorstehend erwähnten
Anwendungen ähnlich
der Reparatur von Knochen oder Knorpel sind, wofür die hierin offenbarten, verbesserten
osteogenen Vorrichtungen nützlich
sind. Zum Beispiel benötigt
keine der vorstehend erwähnten Anwendungen über 6% CMC,
eine gegenwärtig
bevorzugte, implantierbare, verbesserte Vorrichtung der vorliegenden
Erfindung umfasst jedoch mehr als ungefähr 6% (Gew./Gew.) CMC und vorzugsweise
mindestens ungefähr
10%, stärker
bevorzugt ungefähr
12-20%, wobei ungefähr
etwa 16% (Gew./Gew.) oder 1 Teil CMC zu 5 Teilen osteogener Standard-Vorrichtung
unter den gegenwärtig
am meisten bevorzugten Mischungen für eine implantierbare Vorrichtung
ist. Diese ungefähren
Prozentanteile begründen
sich auf Berechnungen des Gesamtgewichts von Matrix, vermischt mit
Bindemittel, ausschließlich
osteogenem Protein und Benetzungsmittel.
-
Wesentlich,
um die vorliegende Erfindung auszuüben, ist die Tatsache, dass
verschiedene Güteklassen
an Carboxymethylcellulose-Natrium im Handel erhältlich sind, welche unterschiedliche
Viskositäten
aufweisen. Die Viskositäten
der unterschiedlichen Gütegrade
an Carboxymethylcellulose-Natrium werden angegeben und nachstehend
in Tabelle 1 gezeigt (siehe Handbook of Pharmaceutical Excipients
(2. Auflage), American Pharmaceutical Association & Royal Pharmaceutical
Society of Great Britain).
-
Tabelle
1: Standard Viskositätsgrade
von Carboxymethylcellulose
-
Etliche
Gütegrade
an Carboxymethylcellulose sind im Handel erhältlich, der am häufigsten
benützte Gütegrad weist
einen Substitutionsgrad (DS) von 0,7 auf. Der DS wird definiert
als die durchschnittliche Zahl an Hydroxylgruppen, die pro Anhydroglucoseeinheit
ausgetauscht sind. Es ist dieser DS, welcher die wässrige Löslichkeit
des Polymers bestimmt. Der Substitutionsgrad und die Standardviskosität einer
wässrigen
Lösung von
bestimmter Konzetration werden auf jedem Carboxymethylcellulose-Natrium-Etikett
angegeben. CMC mit niedriger Viskosität (Aqualon®Division,
Hercules Inc., Wilmington, DE) wird gegenwärtig bevorzugt. Die gegenwärtig bevorzugten
Substitutionsgrade reichen von 0,65-0,90 (DS = 0,7, Aqualon®Typ
7L).
-
Wie
vorstehend beschrieben, ist CMC in mehreren Gütegraden, niedrige, mittlere
und hohe Viskosität, erhältlich.
In diesem Zusammenhang wurde bestimmt, dass die Viskosität der Carboxymethylcellulose
(CMC), die verwendet wurde, um eine verbesserte osteogene Vorrichtung
zu gestalten, entscheidend für
die Knochenbildung war. Im Gegensatz zu den Lehren im Fachgebiet
wurde jetzt herausgefunden, dass CMC mit hoher Viskosität nachteilige
Effekte auf die Knochenbildung hat, wenn sie in einer verbesserten
osteogenen Vorrichtung verwendet wird, umfassend eine wie hierin
definierte Matrix. US-Patentnr. 5,587,897 („das '897-Patent") lehrt, dass die Verwendung von CMC
mit hoher Viskosität
(2480 cP) (siehe Tabelle 1 vorstehend) die Knochenbildung induziert.
Die Vorrichtungen im '897-Patent
benötigen
jedoch eher eine synthetische Polymermatrix als eine biologische
Matrix wie Kollagen. Wenn ein biologisches Material wie zum Beispiel
Kollagen als Matrix verwendet wird, muss die verbesserte Vorrichtung
unerwartet mit CMC mit niedriger Viskosität (ungefähr 10-50 cP, oder 50-200) formuliert
werden, um, wie hierin gelehrt wird, Knochen- und/oder Knorpelbildung
zu induzieren.
-
Toxizitätsstudie
unter Verwendung einer CMC-Vorrichtung
-
Eine
Toxizitätsstudie
wurde durchgeführt,
welche eine verbesserte Vorrichtung, die CMC enthielt, mit einer
Standardvorrichtung verglich. Die Standardvorrichtung wurde mit
2,5 mg OP-1/Gramm Kollagenmatrix erzeugt. Die CMC-enthaltende, verbesserte
Vorrichtung wurde durch Hinzufügen
von CMC mit niedriger Viskosität
(Aqualon®)
zu einer Standardvorrichtung bei einem Verhältnis von 1:5 erzeugt, gefolgt
von Bestrahlung. 25 mg-Aliquote einer Standardvorrichtung oder Scheinvorrichtung
(d.h. kein osteogenes Protein) und 30 mg-Aliquote von CMC, das verbesserte
Vorrichtung oder CMC-Scheinvorrichtung enthielt, wurden, wie anderswo
hierin beschrieben, in eine subkutane Stelle bei der Ratte implantiert
(ein Implantat pro Tier). Drei Implantate aus jeder Rezeptur wurden
nach 7 Tagen, 14 Tagen, 21 Tagen und 28 Tagen nach der Implantation entfernt
und histologisch auf Knochen- und Knorpelbildung und auf lokale
Gewebereaktion bewertet. Es wurden keine nachteiligen zellulären Reaktionen
beobachtet und es gab keinen Hinweis, der irgendeinen nachteiligen
Effekt von CMC andeutete, wie durch Bewertung von Entzündung und
Faserbildung bestimmt wurde. Das histologische Profil der CMC-enthaltenen, verbesserten
Vorrichtung war im Allgemeinen ähnlich
dem der Standard OP-Vorrichtung. Serumcalcium und alkalische Phosphatasemengen,
die unter Verwendung von Standardlehren gemessen wurden, folgten
auch dem der osteogenen Standard-Vorrichtung. Schließlich wurden unter
Verwendung von Standard-Toxizitätsanalysen
auf nicht reifen und reifen Ratten keine signifikanten Läsionen nachgewiesen.
-
Bioaktivitätsstudie
mit verbesserten Vorrichtungen
-
Basierend
auf einer Reihe von nachstehend beschriebenen Routinestudien wurde
die Bioaktivität
einer osteogenen Standardvorrichtung durch die Beimischung von CMC
nicht nachteilig beeinflusst. Stattdessen ist die Bioaktivität für beide
Vorrichtungskonfigurationen mindestens vergleichbar, aber die Fähigkeit,
die Vorrichtung inraoperativ zu verändern und die Vorrichtung während der
Operation und Wundschließung
an der defekten Stelle beizubehalten, wird durch CMC verstärkt. Für diese
Studien wurde bestrahlte CMC vor der Implantation zu der Standardvorrichtung
hinzugefügt.
-
Kurz
gesagt wurden zwei Studien durchgeführt, in welchen die in vivo-Freisetzung von OP-1
aus einer Standardvorrichtung +/– CMC gemessen wurde. In einem
Experiment wurden, wie hierin beschrieben, 75 mg an bestrahlter
Vorrichtung +/– 15
mg an bestrahlter CMC in eine subkutane Stelle in Ratten implantiert.
Die implantierten Vorrichtungen wurden 1 Stunde, 1 Tag, 3 Tage und
6 Tage nach der Implantation entfernt, gefolgt durch Extraktion
mit 8 M Harnstoffpuffer; der OP-1-Gehalt wurde durch Routine-ELISA und
Western-Blot-Analyse analysiert. Die OP-1-Vorrichtung (nicht in die Tiere implantiert)
wurde mit 8 M Harnstoffpuffer extrahiert und als der interne Standard
verwendet. Im Allgemeinen waren die Kinetiken der in vivo-Freisetzung
von OP-1 aus der OP-Standardvorrichtung und der CMC-enthaltenden, verbesserten
Vorrichtung ähnlich.
Die Beobachtung, dass es keinen Unterschied in der OP-1-Sequestrierung
oder -Retention durch eine Standardvorrichtung im Vergleich mit
einer verbesserten Vorrichtung gab, die eine Kombination aus Kollagenmatrix
und CMC enthielt, war ein unerwartetes Ergebnis. Es ist berichtet
worden, dass CMC, wenn sie mit nicht-biologischen polymeren Matrizen
kombiniert wird, dazu dient osteogenes Protein zu sequestrieren.
(Siehe zum Beispiel
US 5,597,897 ).
-
Auch
in vitro-Studien wurden durchgeführt.
In diesen Studien wurde freigesetztes OP-1 im Gegensatz zu den vorstehend
beschriebenen in vivo-Studien gemessen, in welchen OP-1 gemessen
wurde, welches in der Vorrichtung verbleibt. In einer Studie wurden
25 mg der OP-Vorrichtung oder CMC-Vorrichtung mit Salzlösung benetzt.
1 ml an Rinderserum wurde dann zu jeder Vorrichtung hinzugefügt und die
Vorrichtungen wurden bei 37°C
inkubiert. Der Überstand
wurde entfernt und nach 1 und 3 Stunden mit frischem Serum ersetzt.
Nach 6 Stunden wurde 8 M Harnstoff hinzugefügt, um alles noch mit der Vorrichtung
assoziierte OP-1 zu extrahieren. OP-1 Konzentrationen in den Überständen wurden
durch Routine-ELISA-und
Western-Blot-Techniken analysiert. Sowohl die OP-Standardvorrichtung
als auch die CMC-enthaltende, verbesserte Vorrichtung hatten ähnliche
Protein-Freisetzungskinetiken
für die
sechs untersuchten Stunden. Diese Ergebnisse waren im Hinblick auf
frühere
Berichte, dass CMC zur Sequestrierung des osteogenen Proteins wirkt
und dadurch seine Freisetzung von Beimischungen mit synthetischen,
polymeren Matrizen verzögert
und/oder verhindert, wieder unerwartet. (Siehe zum Beispiel
US 5,597,897 ).
-
Zusammenfassend
gesagt hemmt CMC die Retention oder Freisetzung von OP-1 aus einer
Kollagen-Matrix-enthaltenden osteogenen Vorrichtung in vivo oder
in vitro nicht wesentlich.
-
Stabilitätsstudien
-
Eine
Studie (siehe Tabelle 2) wurde durchgeführt, welche die Stabilität der OP-Standardvorrichtung
mit einer Standardvorrichtung verglich, die CMC enthielt. Basierend
sowohl auf in vitro-Analysen und einem Knochenbildungs-Biotest (anderswo
hierin beschrieben) wurde beobachtet, dass die CMC-enthaltende,
verbesserte Vorrichtung mindestens so stabil war wie die Standardvorrichtung,
wenn sie für
ein Jahr bei 30 Grad gelagert wurde. Die Daten deuten auch darauf
hin, dass CMC mit der OP-Standardvorrichtung vorgemischt werden
kann und schlussendlich für
eine einheitliche Produktkonfiguration sterilisiert werden kann.
Ein solches einheitliches Produkt ist, wie nachstehend beispielhaft
dargestellt, für
die Reparatur von lokalen Knochen- und Knorpeldefekten nützlich.
-
TABELLE
2: Stabilität
von unterschiedlichen osteogenen Vorrichtungsformulierungen
-
Während der
Formulierung einer CMC-enthaltenden Standardvorrichtung können CMC
und osteogene Proteine getrennt sterilisiert werden, zum Beispiel
durch Inkontaktbringen mit Gammastrahlung und dann Vereinigung der
sterilisierten Komponenten, um die Standardvorrichtung zu erzeugen,
die CMC enthält.
Darüber
hinaus kann CMC mit der OP-Standardvorrichtung vorher zusammengemischt
und die resultierende Formulierung sterilisiert werden, zum Beispiel
durch Inkontaktbringen mit Gammastrahlung. Der spätere Prozess wird
im Fachgebiet als terminale Sterilisierung bezeichnet und ist verwendet
worden, um andere osteogene Vorrichtungen zu sterilisieren. Siehe
zum Beispiel PCT/US96/10377, veröffentlicht
als WO 96/40297, am 19. Dezember 1996 und
US 5,674,292 , erteilt am 7. Oktober
1997. Wie hierin verwendet beziehen sich die Begriffe „Sterilisierung" und „sterilisiert" auf einen Prozess
unter Verwendung von entweder physikalischen oder chemischen Mitteln
zur Eliminierung von im Wesentlichen allen lebensfähigen Organismen,
insbesondere Mikroorganismen, Viren und anderen Pathogenen, die
mit der Vorrichtung der Erfindung in Verbindung stehen. Die sterilisierten
Vorrichtungen der Erfindung weisen vorzugsweise, wie durch Federal
Drug Administration (FDA)-Standards
bestimmt, einen Sterilisierungs-Gewissheitsgrad von 10
–6 auf.
Im Falle der Gamma-bestrahlten Vorrichtungen können die geeigneten Bestrahlungsdosierungen,
die für
die Sterilisierung einer bestimmten Vorrichtung notwending sind,
zum Beispiel leicht durch Nachschlagen im Text des Dokuments „Associate
for the Advancement of Medical Instrumentation Guidelines," veröffentlicht
1992, bestimmt werden. Darin werden Richtlinien für die Bestimmung
der Bestrahlungsdosis bereitgestellt, die notwendig ist, um einen
bestimmten Sterilisierungs-Gewissheitsgrad für eine bestimmte biologische
Belastung der Vorrichtung zu erzielen. Dosierungen für die Sterilisierung
der Vorrichtungen der Erfindung liegen vorzugsweise innerhalb des
Bereichs von 0,5 bis etwa 4.0 Megarad und am meisten bevorzugt liegen
sie innerhalb des Bereichs von 2.0 und etwa 3.5 Megarad.
-
Außerdem wurde
eine Studie durchgeführt,
um die Kurzzeitstabilität
einer osteogenen Vorrichtung zu bewerten, zu welcher CMC und Salzlösung hinzugefügt worden
sind. Die Studie verwendete eine Standardvorrichtung, zu welcher
200 mg an getrennt verpackter, bestrahlter CMC hinzugefügt wurde.
Die Proben von CMC-enthaltender,
verbesserter Vorrichtung wurden entfernt und mit Salzlösung benetzt.
Bei 0, 1, 3, 6 und 22 Stunden wurde das OP-1 mit 8 M Harnstoffpuffer
extrahiert und durch Umkehrphasen-HPLC unter reduzierenden Bedingungen
analysiert. Die Extrakte wurden mit einem auf Zellen basierenden
Standardtest zur Messung von alkalischer Phosphatase auch auf 1-biologische
OP-Aktivität
untersucht. Die Daten deuteten darauf hin, dass OP-1 die biologische
Aktivität
unter diesen Bedingungen beibehält.
Diese Daten deuteten auch darauf hin, dass die Konfiguration der
CMC-enthaltenden,
verbesserten Vorrichtung aus der Beimischung dieser Komponententeile
(osteogene Standardvorrichtung/CMC/Salzlösung) resultieren und für mehrere
Stunden, nachdem sie erzeugt worden ist, verwendbar ist, was für den Praktiker
signifikante intraoperative Zeit bereitstellt, während welcher das Produkt wirksam
bleibt.
-
Testen der Integrität und anderen
Eigenschaften des Bindemittels
-
Im
Fachgebiet anerkannte USP-Verfahren wurden zur Identifizierung und
Charakterisierung von voluminösen
Bindemitteln wie zum Beispiel CMC verwendet. Untersuchungen schlossen
Tests auf chemische Identität,
Viskosität,
pH-Wert, Verlust bei Trocknung und Schwermetallen ein. Materialien
wurden vor der Sterilisierung auch auf die biologische Belastung
sowie auf Endotoxine, pH-Wert, Aussehen und Sterilität nach der Bestrahlung
untersucht. Eine Stabilitätsstudie
wurde durchgeführt,
um die Viskosität,
das Aussehen und den pH-Wert des bestrahlten Materials zu kontrollieren.
Alle Grade und Eigenschaften waren annehmbar, wie unter Verwendung
von Standardverfahren und -Techniken bestimmt wurde.
-
Zum
Beispiel wurde CMC (Aqualon®-niedrige Viskosität) auf biologische
Belastung und Endotoxingehalt untersucht: Aqualon® CMC,
Charge FP10 12342 wurde unter Verwendung des Kinetic Chromogenic LAL-Tests
von BioWhittaker (Walkersville, MD, 21793) auf die Anwesenheit von
Endotoxinen (LAL) untersucht.
-
Die „biologische
Belastung" kann
wie folgt gemessen werden. Zum Beispiel wurden 200 mg Proben von
CMC in 100 ml Phosphat-gepuffertem Wasser solubilisiert und durch
0,45-μm-Filter
filtriert. Die Filter wurden auf eine TSA-Platte gelegt und für 48 Stunden
inkubiert. Zwei Proben von solubilisierter CMC wurden mit 10-100
KbE von Bacillus subtilis inkubiert, um als Wachstumskontrollen
verwendet zu werden. Die Daten deuten darauf hin, dass die biologischer
Belastung der CMC niedrig ist und dass CMC nicht mit der Analyse
durch die Tötung
der Bakterien oder die Hemmung des Zellwachstums interferiert.
-
CMC-Charakterisierung
nach der Bestrahlung
-
Eine
Studie wurde durchgeführt,
in welcher die Viskosität
von CMC vor und nach der Bestrahlung verglichen wurde (Gamma-Bestrahlung,
2,5-3,0 Megarad). Die Daten deuten darauf hin, dass, wie im Fachgebiet berichtet,
die Viskosität
nach der Bestrahlung abnimmt Während
das die Bioaktivität
oder ihre allgemeine Nützlichkeit
als ein Bindemittel nicht beeinflusste (siehe Studien, die hierin
dargelegt sind), sollte der Fachmann dieses Merkmal bedenken, wenn
er die Viskositäts-
oder Fluiditätsmerkmale
einer verbesserten osteogenen Vorrichtung bewertet. Es wurde auch
eine Studie durchgeführt,
um die Stabilität
von bestrahlter CMC zu bewerten. Die Ergebnisse deuten darauf hin,
dass bestrahlte CMC sowohl bei 4 als auch bei 30°C für mindestens sechs Monate stabil
war. Die Viskosität
wurde als der Parameter an Stabilität gemessen. Ähnliche
Analysen und Bewertungen können
für andere
Bindemittel oder Vorrichtungsmaterialien durchgeführt werden,
die in einer gewünschten
Formulierung verwendet werden.
-
B. Fibrinkleber als Bindemittel
-
Wie
hierin beschrieben, ist „Fibrinkleber" ein anderes Bindemittel.
Fibrinkleber umfasst ein Gemisch aus Säugerfibrinogen und Thrombin.
Menschliches Fibrinogen ist im Handel in Produkten wie zum Beispiel: Tissucol® (ImmunoAG,
Wien, Österreich),
Beriplast® (Beringwerke,
Marburg, Deutschland), Biocoll® (Centre de Transfusion
Sanguine de Lille (Pours, Frankreich) und Transglutine® (CNTS
Fractionation Centre, Straßburg, Frankreich)
erhältlich,
ist aber nicht darauf beschränkt.
Menschliches Thrombin ist im Handel durch ImmunoAG, Wien, Österreich
erhältlich.
Fibrinkleber kann auch aus Fibrinogen und Thrombin aus anderen Säugerquellen,
wie zum Beispiel Rinder- oder murinen Quellen, hergestellt werden.
-
Fibrinkleber
wurde basierend auf seinen Gel-ähnlichen
Eigenschaften und seinen verbesserten Handhabungseigenschaften,
wenn er mit einem Matrixmaterial wie zum Beispiel Kollagen oder β-TCP gemischt wurde,
als ein Kandidaten-Bindemittel
ausgewählt.
Es wurde gezeigt, dass Fibrinkleber eine schwache entzündliche
Reaktion (siehe nachstehend) hervorrief und die Knochenbildung förderte.
-
Toxizitätsstudien
unter Verwendung einer Fibrinklebervorrichtung
-
Eine
Toxizitätsstudie
wurde durchgeführt,
welche eine verbesserte Vorrichtung, die Fibrinkleber enthielt,
mit einer Standardvorrichtung verglich. Die Standardvorrichtung
wurde durch Mischen von 10 μg
OP-1 in 47,5% Ethanol/0,01% TFA und 25 mg Kollagen und Lyophilisieren
der Mischung über
Nacht erzeugt. Die Standardvorrichtung wurde vor der Implantation
mit 100 μl
Phosphat-gepufferter Salzlösung
(PBS) benetzt. Die verbesserte Vorrichtung, die Fibrinkleber enthielt,
wurde durch Hinzufügen
von 50 μl
Rinder-Fibrinogen (Sigma F8630, 10 mg/ml) und 50 μl Rinderthrombin
(50 E/ml) zu der Standardvorrichtung, die wie vorstehend erzeugt wurde,
unverzüglich
vor der Implantierung erzeugt. Die Standardvorrichtung und die verbesserte
Vorrichtung, die Fibrinkleber enthielt, wurden dann, wie anderswo
hierin beschrieben, in eine subkutane Stelle in der Ratte implantiert.
Die Implantate wurden histologisch auf Knochen- und Knorpelbildung
hin bewertet und auf lokale Gewebereaktion untersucht. Die verbesserte
Vorrichtung, die Fibrinkleber enthielt, rief eine schwache entzündliche
Reaktion und schwache Faserbildung hervor. Das histologische Profil
der verbesserten Vorrichtung, die Fibrinkleber enthielt, war im
Allgemeinen ähnlich
jenem der Standardvorrichtung. Es schien keine Korrelation zwischen
entzündlicher
Reaktion und der Fähigkeit
der Fibrinkleberenthaltenden, verbesserten Vorrichtung zu bestehen,
die Knochenbildung zu fördern.
-
Bioaktivitätsstudien
der verbesserten Vorrichtung
-
Eine
Studie wurde durchgeführt,
um in vitro bei unterschiedlichen Thrombinkonzentrationen die Freisetzungskinetik
von OP-1 aus einer verbesserten Vorrichtung zu bewerten, die Fibrinkleber
enthielt. Freisetzungskinetiken wurden durch Hinzufügen von
großen
Mengen an Thrombin verbessert. Für
diese Studie wurden 12,5 μl
OP-1 in einer 5% Lactoselösung
mit 50 mg β-TCP,
25 μl menschlichem
Fibrinogen und entweder 25 E/ml an menschlichem Thrombin oder 50
E/ml menschlichem Thrombin gemischt. Die Gemische wurden in ein
Glasröhrchen
transferiert und 1 ml Kälberserum
wurde zu jedem hinzugefügt.
Den Proben wurden dann ermöglicht,
bei 37°C/60
UpM zu inkubieren. Serumproben wurden entnommen und durch Routine-ELISA
bei 0-1 Stunde, 1-3 Stunden, 3-5 Stunden und 5-24 Stunden analysiert.
Die Ergebnisse werden in der nachfolgenden Tabelle zusammengefasst.
-
-
III. FORMULIERUNG UND
VERABREICHUNGSERWÄGUNGEN
-
Allgemeine Erwägungen
-
Die
Vorrichtungen der Erfindung können
unter Verwendung von Routineverfahren formuliert werden. Es wird
einzig die Bestimmung der erwünschten
Endkonzentration von osteogenem Protein pro Vorrichtung benötigt, indem
man bedenkt, dass das Verabreichungsvolumen der Vorrichtung weniger
als das Volumen der defekten Stelle sein kann, aber nicht nötigerweise
weniger sein muss. Die gewünschte
Endkonzentration des Proteins wird von der spezifischen Aktivität des Proteins
abhängen,
sowie von der Art, dem Volumen und/oder der anatomischen Lage des
Defekts. Außerdem
kann die gewünschte
Endkonzentration des Proteins von Alter, Geschlecht und/oder allgemeiner
Gesundheit des Empfängers
abhängen. Üblicherweise
wurde für
einen segmentalen Defekt von kritischer Größe, der ungefähr mindestens
2,5 cm lang ist, beobachtet, dass 0,5-1,75 mg osteogenes Protein
von unter Verwendung einer Standardvorrichtung die Knochenbildung
ausreichend zu induzieren kann, um die Lücke zu reparieren. Im Falle
eines Defekts von nicht kritischer Größe oder eines frischen Bruchs
wurden unter Verwendung der osteogenen Standardvorrichtung beobachtet,
dass ungefähr 0,1-0,5
mg Protein den Defekt reparieren. Im Allgemeinen können sich
die Proteinkonzentrationen zur Verwendung mit den hierin beschriebenen,
bevorzugten Matrizen von etwa 0,4 mg bis zu etwa 3,0 mg pro Vorrichtung bewegen.
Die Optimierung von Dosierungen benötigt nicht mehr als Routineuntersuchungen
und liegt innerhalb des Fachkönnens
eines Fachmanns.
-
Wie
hierin beispielhaft dargestellt, können das osteogene Protein
und ein Bindemittel wie zum Beispiel Carboxymethylcellulose (niedrige
Viskosität,
Aqualon®)
oder ein Fibrinkleber gemischt werden, um einen Kitt zu bilden.
In manchen Ausführungsformen
wird Salzlösung
zum Bindemittel hinzugefügt,
um eine Paste oder einen Kitt zu bilden, in welchem ein osteogenes
Protein wie zum Beispiel OP-1 verteilt ist. Eine Pastenkonfiguration
kann verwendet werden, um die Oberflächen eines Defekts wie zum
Beispiel ein Loch auszustreichen. Pasten können verwendet werden, um Frakturdefekte,
chondrale oder osteochondrale Defekte, sowie Knochendefekte an der
protethischen Implantationsstelle auszustreichen. Eine flüssigere
Konfiguration kann injiziert oder in oder entlang der Oberfläche eines
Defekts herausgedrückt
werden, in einen ähnlichen
Weise wie das Herausdrücken
von Zahnpasta oder Abdichtmaterialien aus einer Tube, sodass ein
Wulst der Vorrichtung entlang der Länge der Defekt-Stelle verabreicht
wird. Üblicherweise
wird der Durchmesser des herausgedrückten Wulsts durch die Art
des Defekts sowie durch das Volumen des Leerraumes der defekten
Stelle bestimmt.
-
Wie
vorstehend erwähnt,
können
andere, wie vorstehend hierin definierte, Bindemittel verwendet
werden, um eine Vorrichtung mit einer Konfiguration wie Kitt zu
formulieren. Wie für
einen Fachmann offensichtlich sein wird, resultiert eine solche
Konfiguration aus dem Einstellen der Verhältnisse an Träger im Vergleich
zu Benetzungsmittel, indem weniger Benetzungsmittel eine trockenere
Vorrichtung ergibt und mehr eine feuchtere Vorrichtung erzeugt.
Die genaue Vorrichtungskonfiguration, die zur Reparatur eines Defekts
geeignet ist, wird zumindest von der Defektart und der Größe des Defekts
abhängen.
Für den
Fachmann werden diese Variablen klar sein.
-
A. CMC als ein Bindemittel — Formulierungsstudien
-
Basierend
auf den folgenden Arten von Studien wurde festgestellt, dass ungefähr 0,2 g
CMC zu ungefähr
1,0 g osteogener Standardvorrichtung eine verbesserte Vorrichtung
mit den gegenwärtig
bevorzugten Handhabungseigenschaften ergibt. Unterschiedliche Verhältnisse
von CMC und Kollagen wurden kombiniert und dann mit Salzlösung benetzt.
Jedes resultierende Gemisch an CMC und Matrix wurde in einem konischen 15-ml-Zentrifugenröhrchen in
Wasser suspendiert und in einen Rotationsschüttler (100 UpM) gestellt. Setzungszeit
wurde aufgezeichnet, wenn sich gelockerte oder freigesetzte Kollagenmatrixpartikel
an einer vorbestimmten Marke an dem Röhrchen abgesetzt hatten. Die
in Tabelle 3 und 1 zusammengefassten Daten deuten
darauf hin, dass ein Bereich von ungefähr 0,15 bis 0,25 g CMC/g Kollagen
die Kohäsivität, Integrität und Handhabungseigenschaften
maximieren können.
-
TABELLE
3: Effekt des CMC/Kollagen-Verhältnis
auf die Dispersionszeit
-
Die
bevorzugte Menge an Salzlösung
zur Benetzung der CMC-Vorrichtung wurde auch untersucht. In dieser
Studie wurden ungefähr
0,2 g CMC mit ungefähr
1 g osteogener Standardvorrichtung gemischt. Unterschiedliche Mengen
an Salzlösung
wurden hinzugefügt
und die Konsistenz der daraus resultierenden Vorrichtung wurde festgehalten.
Die quantitativen und qualitativen Ergebnisse aus dieser Studie
werden in Tabelle 4 bzw. 2 zusammengefasst.
Im Allgemeinen zeigen diese Daten, dass es einen Bereich an Benetzungsmittelvolumina
gibt, welcher dem Praktiker entgegenkommt, während er der Vorrichtung ermöglicht ihre
Integrität und
Kohäsivität beizubehalten.
Für ein
Bindemittel wie CMC weisen diese Daten darauf hin, dass mehr als
ungefähr
1,5 ml, ungefähr
1,8 bis 2,5 ml an Salzlösung
gegenwärtig
das bevorzugte Benetzungsvolumen darstellen (für ungefähr 1 Gramm an Vorrichtung,
die mit ungefähr
200 mg an Bindemittel wie zum Beispiel CMC vermischt ist), um eine
implantierbare Vorrichtung mit der gegenwärtig bevorzugten Kitt-Konsistenz
zu erzielen. Mengen an Salzlösung
im Überschuss
davon erzielen eine injizierbare Vorrichtung mit der gegenwärtig bevorzugten
Flüssigkeitskonsistenz.
Wie anderswo hierin beispielhaft dargestellt wird, ist eine implantierbare
Vorrichtungskonfiguration für
die Verwendung in einer offenen Defekt-Stelle geeignet, während eine
injizierbare Vorrichtungskonfiguration für die Verwendung in einer geschlossenen
Defekt-Stelle geeignet ist. Im Hinblick auf Gramm-Äquivalente
sind ungefähr
0,5 g bis ungefähr
3,0 g Salzlösung
bestimmt worden, um verbesserte Vorrichtungen mit erwünschten
Konsistenzen zu ergeben; je höher
das Gewicht, desto besser injizierbar ist die Konfiguration.
-
TABELLE
4: Benetzung der CMC-enthaltenden Vorrichtung
-
In
bestimmten Ausführungsformen
der vorliegenden Erfindung kann die Erzeugung der eigentlichen, verbesserten
osteogenen Vorrichtung unmittelbar vor ihrer Verabreichung an die
Defekt-Stelle erfolgen. Wie hierin beispielhaft dargestellt, können CMC-enthaltende,
verbesserte Vorrichtungen vor Ort erzeugt werden, die für die Beimischung
unmittelbar vor der Operation geeignet sind. In einer Ausführungsform
wurde CMC mit niedriger Viskosität
(Aqualon®)
getrennt vom osteogenen Protein OP-1 und der Kollagenmatrix verpackt
und bestrahlt. Das OP-1-Protein
in der Kollagenmatrix wurde dann mit dem Bindemittel vermischt.
Von Vorrichtungen, die in dieser Art erzeugt wurden, wurde beobachtet,
dass sie mindestens biologisch so aktiv sind wie Standardvorrichtungen
ohne CMC.
-
B. Fibrinkleber als ein
Bindemittel — Formulierungsstudien
-
Basierend
auf der folgenden Art von Studien wurde festgestellt, dass ungefähr 500 μl Fibrinogen
(80 mg/ml in PBS bei pH-Wert 7,4) und 500 μl Thrombin (50 E/ml oder 25
E/ml in 0,9% NaCl), die zu ungefähr
1 g an β-TCP
hinzugefügt
wurden, eine verbesserte Vorrichtung mit den gegenwärtig bevorzugten
Handhabungseigenschaften ergaben. Angelegenheiten, die mit den Handhabungseigenschaften
in Zusammenhang stehen, umfassen Gerinnungszeit des Fibrinklebers
und Konsistenz der verbesserten Vorrichtung, die Fibrinkleber enthält. Eine
Vorrichtung, welche eine Konsistenz eines formbaren Kitts enthält, wird
bevorzugt. Sobald der Kleber gerinnt, wird es schwieriger, die Form
des Kitts zu ändern.
Eine längere
Gerinnungszeit ist daher auch ein bevorzugtes Merkmal der Vorrichtung.
-
Die
Gerinnungszeit von Rinderfibrinkleber wurde bestimmt durch unaufhörliches
Mischen von 20 μl Rinder-Fibrinogenlösung (80
mg/ml in PBS bei pH-Wert
7,4) mit 20 μl
Rinderthrombinlösung
(500 E/ml oder 25 E/ml in Salzlösung)
in einem Gewichtsboot unter Verwendung eines Glaskapillarenstabs
bestimmt. Die Gerinnungszeiten wurden auch mit oder ohne Hinzufügen von
0,6% CaCl2-Lösung bewertet. Die Ergebnisse
werden in der folgenden Tabelle gezeigt:
-
-
Die
Konsistenz der Vorrichtung, die Fibrinkleber enthält, wurde
unter Verwendung einer Vorrichtung bewertet, die β-TCP als
eine beispielhafte Matrix enthielt. Unterschiedliche Mengen an Rinder-Fibrinkleber wurden
zu 100 mg oder 1000 mg an β-TCP-Körnchen hinzugefügt und die
Konsistenz wurde bestimmt. Die Ergebnisse werden in der nachstehenden
Tabelle zusammengefasst:
-
-
Wie
durch diese beiden Studien erkannt werden kann, weist eine Vorrichtung,
die Fibrinkleber von ungefähr
500 μl Fibrinogen
(80 mg/ml in PBS bei pH-Wert 7,4) und 500 μl Thrombin (50 E/ml oder 25
E/ml in 0,9% NaCl) enthält
und welche zu ungefähr
1 g von β-TCP
hinzugefügt
wird, eine Gerinnungszeit und Konsistenz auf, die für eine verbesserte
osteogene Vorrichtung geeignet ist. TABELLE
4C: Repäsentative
Information betreffend die Zusammensetzung von Fibrinkleber
- 1. Autocolle® und
Biocolle® sind
von Centre de Transfusion Sanguine de Lille (Tours, Frankreich)
- 2. Tissucol® ist
von Immuno AG (Wien, Österreich)
- 3. Beriplast® ist von Behringwerke
(Marburg, Deutschland)
- 4. Transglutine® ist von CNTS Franctionation
Centre (Straßburg,
Frankreich)
-
Basierend
auf den vorstehend beschriebenen Studien wurde festgestellt, dass
ungefähr
40 mg Fibrinkleber bis ungefähr
1000 mg β-TCP
eine hierin in Erwägung
gezogene, verbesserte Vorrichtung ergibt. Basierend auf den gleichen
Studien wurde festgestellt, dass ungefähr 20 mg Fibrinkleber zu ungefähr 1000
mg Kollagen eine Vorrichtung mit den hierin dargelegten, verbesserten
Eigenschaften ergibt. Im Allgemeinen deuten die Daten darauf hin,
dass ein Bereich von ungefähr
20-220 mg Fibrinkleber/1000 mg Matrix die Kohäsivität, Integrität und Handhabungseigenschaften
abhängig
von der genauen Umständen
und der vorgesehenen Verwendung maximieren kann.
-
IV. ANDERE MATERIALERWÄGUNGEN
-
In
bestimmten Ausführungsformen
der Erfindung ist das bevorzugte Matrixmaterial β-TCP. Bevorzugte Eigenschaften
eines nicht-synthetischen, nicht- polymeren
Materials zur Verwendung als eine Matrix in der beanspruchten Erfindung
schließen
ein, sind aber nicht beschränkt
auf: eine hohe Resorptionsrate der Matrix durch das umgebende Gewebe
und eine geringe entzündliche
Reaktion. Wie vorstehend besprochen, ist gesintertes, hoch gebrannte β-TCP, welches
eine Partikelgröße im Bereich
von etwa 212 um bis zu etwa 425 μm aufweist,
gegenwärtig
am meisten bevorzugt, aber andere Partikelgrößen können verwendet werden, um die vorliegende
Erfindung zu praktizieren.
-
Bildanalyseverfahren
-
Die
Resorptionsrate der β-TCP-Matrix
wurde unter Verwendung eines Standard-Bildanalyseverfahrens bestimmt.
Die Bildanalyse ist ein Verfahren zur Evaluierung der Patikelgrößeverteilung
von Ca/P-Körnchen.
Die Partikelgröße von Ca/P-Körnchen wird
vor und nach der Implantierung in Ratten verglichen. Die weichen
Gewebe der Eplantate werden durch Natrium-Hypochlorit aufgelöst und die
verbleibenden Ca/P-Körnchen
wurden mehrmals mit Wasser gewaschen und bei Raumtemperatur getrocknet.
Die Partikel werden mit Glycerin gemischt und auf Glasobjektträger aufgetragen.
Die Partikelgröße wird
durch Mikroskopie unter Verwendung eines Standard-Bildanalysesystems
wie zum Beispiel Bioquant OS/2 bestimmt, welches durch eine Videokamera
an das Mikroskop gekoppelt ist. Anordnungen, welche den Bereich
und den längsten
Durchmesser anzeigen, werden ausgewählt, um die einzelnen Partikeldimensionen
auszudrücken.
Partikelbilder, welche Grauskalen von 0 bis 88 von einer Serie mit
256 Abstufungen anzeigen, wurden ausgewählt und gemessen. Die Rohdaten
aus einzelnen Partikeln wurden verwendet, um das Mittel und die
Standardabweichung zu berechnen. Mindestens 50 Partikel wurden in
jedem Datensatz gemessen.
-
Ratten-Subkutanstudie
-
In
der nachstehend dargelegten Studie wird β-TCP (Clarkson, #211096, BD
= 0,86, 212-425 μm, 9/6/97)
in einer CMC/Blutpaste mit oder ohne 10 μg OP-1 formuliert und in subkutane
Stellen in Ratten implantiert. Die Implantate werden nach 6 und
12 Wochen in vivo entfernt und unter Verwendung des vorstehend beschriebenen
Bildanalyseverfahrens analysiert. Resultate nach sechs Wochen werden
nachstehend in Tabelle 4D zusammengefasst. Die Ergebnisse nach sechs Wochen
deuten darauf hin, dass sich die Größe von β-TCP von 334 μm auf 184 μm (ohne OP-1)
und auf 166 μm
(mit OP-1) vermindert. Der Größenunterschied zwischen
mit OP-1 behandelten und nicht behandelten Proben ist nicht signifikant.
Es besteht jedoch eine etwa 50% Reduktion im Durchmesser des β-TCP nach
sechs Wochen.
-
TABELLE
4D IN
VIVO-RESORPTION VON β-TCP
NACH 6 WOCHEN
-
TABELLE
4E: Quelle und Zusammensetzung von manchen bevorzugten Matrix-Materialien und bevorzugten Komponenten
an Fibrinkleber.
-
-
Entzündung
-
Im
Allgemeinen kann angenommen werden, dass kleine Partikel schneller
resorbiert werden als große Partikel.
Die Ergebnisse deuten darauf hin, dass ohne OP-1 β-TCP (212-425 μm) eine etwas
erhöhte
entzündliche
Reaktion hervorrief. Die entzündliche
Reaktion wurde jedoch vermindert, als die Dosis von OP-1 von 10 μg auf 20 μg anstieg.
Frühere
Tierstudien haben gezeigt, dass kleine Partikel, weniger als 10 μm, eine stärkere entzündliche
Reaktion hervorrufen. Die Verwendung von gesinterten β-TCP (100%)-Partikeln
der Größe von 212
bis 425 μm
ist daher ein Ausgleich zwischen Resorptionsrate, niedriger Entzündung und
der Fähigkeit,
die Knochenbildung im subkutanen Modell der Ratte zu unterstützen.
-
V. BIOTEST
-
A. Biotest auf osteogene
Aktivität:
Endochondrale Knochenbildung und ähnliche Eigenschaften
-
Das
folgende legt beispielhafte Protokolle zur Identifizierung und Charakterisierung
von bona fide osteogenen oder morphogenetischen Knochenproteinen,
sowie auch osteogenen Vorrichtungen innerhalb des Geltungsbereichs
der Erfindung des Anmelders dar.
-
Der
im Fachgebiet anerkannte Biotest für Knocheninduktion, wie beschrieben
durch Sampath und Reddi (Proc. Natl. Acad. Sci. USA (1983) 80:6591-6595)
und US-Patentnr. 4,968,590, wird verwendet, um die Effizienz des
Reinigungsprotokolls zu bewerten. Kurz gesagt besteht dieser Test
aus dem Deponieren der Testproben in subkutanen Stellen in allogenen
Empfängerratten
unter Etheranästhesie.
Ein vertikaler Einschnitt (1 cm) wird unter sterilen Bedingungen
in der Haut über
der Brustregion durchgeführt
und durch stumpfe Sektion wird eine Tasche hergestellt. Unter bestimmten
Umständen
werden ungefähr
25 mg der Testprobe tief in eine Tasche implantiert und der Einschnitt
mit einer metallenen Hautklammer verschlossen. Die heterotrope Stelle
ermöglicht
das Studium der Knocheninduktion ohne die möglichen Ungewissheiten, die
aus der Verwendung von orthotropen Stellen resultieren.
-
Die
sequentiellen zellulären
Reaktionen, welche an der heterotropen Stelle vorkommen, sind komplex. Die
Mehrschritt-Kaskade der endochondralen Knochenbildung umfasst: Bindung
von Fibrin und Fibronectin an die implantierte Matrix, Chemotaxis
von Zellen, Proliferation von Fibroblasten, Differenzierung in Chondroblasten,
Knorpelbildung, vaskuläre
Invasion, Knochenbildung, Umbau und Knochenmarksdifferenzierung.
-
In
Ratten zeigt dieses Biotestmodell ein kontrolliertes Fortschreiten
durch die Stadien von Matrix-induzierter endochondraler Knochenentwicklung,
einschließlich:
(1) transienter Infiltration durch polymorphnucleäre Leukocyten
am ersten Tag; (2) mesenchymaler Zellmigration und -Proliferation
an den Tagen zwei und drei; (3) Erscheinen von Chondocyten an den
Tagen fünf
und sechs; (4) Knorpel-Matrixbildung
am siebten Tag; (5) Knorpelverkalkung am achten Tag; (6) vaskuläre Invasion,
Erscheinen von Osteoblasten und Bildung von neuem Knochen an den
Tagen neun und zehn; (7) Erscheinen von osteoblastischen und Knochenumformungen an
den Tagen 12 bis 18; und (8) hämatopoietische
Knochenmarks-Differenzierung im Ossicel am Tag 21.
-
Herstellung
histologischer Schnitte und Färbung
werden bevorzugt, um das Ausmaß der
Osteogenese in den Implantaten zu bestimmen. Die Färbung mit
Toluidinblau oder Hämatoxylin/Eosin
zeigt klar die endgültige
Entwicklung des endochondralen Knochens. Zwölf Tage Biotests sind ausreichend,
um zu bestimmen, ob mit der Testprobe knocheninduzierende Aktivität in Zusammenhang
steht.
-
Außerdem kann
alkalische Phosphataseakivität
als ein Marker für
die Osteogenese verwendet werden. Die Enzymaktivität kann spektrophotometrisch
nach Homogenisierung des herausgeschnitten Testmaterials bestimmt
werden. Die Aktivitätspeaks
an beiden Tagen 9-10 in vivo und danach fallen langsam ab. Proben,
die histologisch keine Knochenentwicklung zeigen, sollten unter
diesen Testbedingungen keine alkalische Phosphataseaktivität aufweisen.
Der Test ist für
die Quantifizierung und die sehr schnelle Erlangung einer Abschätzung der
Knochenbildung nützlich,
nachdem die Testproben aus der Ratte entfernt wurden. Zum Beispiel sind
Proben, die osteogenes Protein mit verschiedensten Reinheitsgraden
enthielten, getestet worden, um den effektivsten Dosierungs/Reinheitsgrad
zu bestimmen, um eine Formulierung zu finden, die in industriellem Maßstab erzeugt
werden kann. Die durch alkalische Phosphatase-Aktivitätsmengen gemessenen Ergebnisse und
die histologische Bewertung, können
als „Knochenbildungseinheiten" dargestellt werden.
Eine knochenbildende Einheit stellt die Menge an Protein dar, die
für halbmaximale
Knochenbildungsaktivität
an Tag 12 benötigt
wurde. Außerdem
können
Dosierungskurven für
die Knocheninduzierende Aktivität
in vivo bei jedem Schritt eines Reinigungsschemas durch Testung
verschiedener Proteinkonzentrationen erstellt werden. Demgemäß kann der
Fachmann nur unter Verwendung von Routineuntersuchungen repräsentative
Dosierungskurven erstellen.
-
B. Knorpelbildung: Immunhistochemie,
Histologie und polarisierte Lichtmikroskopie
-
I. Immunhistochemie und
Histologie
-
Kurz
gesagt ist es im Fachgebiet gut bekannt, dass die Identifizierung
von bona fide Gelenkknorpel unter Verwendung von ultrastrukturellen
und/oder biochemischen Parametern erreicht werden kann. Zum Beispiel
bildet Gelenkknorpel eine durchgehende Schicht an Knorpelgewebe,
die identifizierbare Zonen aufweist. Die oberflächliche Zone ist durch Chondrocyten
gekennzeichnet, welche eine abgeflachte Morphologie und ein extrazelluläres Netzwerk
aufweisen, das sich mit Toluidinblau nicht oder nur schwach anfärben lässt, das
weißt auf
die relative Abwesenheit von sulfatierten Proteoglycanen hin. Toluidinblau
wird herkömmlicherweise
zur Färbung
von Knochen- und Knorpel verwendet. Es ist ein metachromatischer
Farbstoff, der basierend auf der Anwesenheit von dicht gelegenen
negativen Ladungen in den Geweben unterschiedliche Farben ergibt,
wobei es zu einer Aggregation und Polymerisation des Farbstoffs
kommt, wobei sich die Farbe von blau zu violett verändert. Knochen
wird blau gefärbt,
während
der Knorpel mit seinen sauren Mucopolysacchariden dunkel violett
gefärbt
wird. Chondrocyten in den mittleren und tiefen Zonen weisen ein
sphärisches
Erscheinungsbild auf und die Matrix enthält reichlich sulfatierte Proteoglycane,
wie durch die Färbung
mit Toluidinblau bewiesen wird. Kollagenfasern sind diffus in der
gesamten Matrix vorhanden. Die Chondrocyten besitzen reichlich rauhes endoplasmatisches
Retikulum und sind umgeben von einem extrazellulären Netzwerk. Das perizelluläre Netzwerk
enthält
zahlreiche, dünne,
nicht-bandförmige
Kollagenfasern. Das Kollagen im interterrilorialen Netzwerk ist
weniger gepackt und in elektronendurchlässiges, amorphes Material eingebettet, ähnlich dem
Gelenkknorpel. Kollagenfasern in der interterritorialen Region des
Netzwerks zeigen die periodischen Bandierungseigenschaften von Kollagenfasern
in der interterritorialen Zone von Knorpelgewebe.
-
Von
Kossa-Färbung
zeigt eine dichte, schwarze Färbung
des mineralisierten Gewebes. Diese Färbung stellt durch die Ablagerung
von Silber auf den Calciumsalzen den bestehenden und neuen regenerierten Knochen
klar dar. Üblicherweise
ist die Gegenfärbung
Safranin O, welches den Knorpel rot-orange färbt. Neuer und bestehender
Knochen kann normalerweise leicht morphologisch in entsprechend
gefärbten
Abschnitten unterschieden werden. Safranin-O/Fast Green ist im Stande,
mehrere Merkmale zu unterscheiden als Toluidinblau. Safranin O ist
ein alkalischer Farbstoff, der saure Mucopolysaccharide im Gelenkknorpel
rot-orange und den darunterliegenden subchondralen Knochen nur leicht
färbt.
Fast Green ist ein saurer Farbstoff, der das Cytoplasma grau-grün färbt Dieser
Farbstoff ist nicht nur in der Lage, den bestehenden und regenerierten Knorpel
klar zu identifizieren, sondern kann auch die Unterschiede zwischen
zwei Regionen im wiederaufgebauten Reparaturgewebe unterscheiden;
das deutet auf Unterschiede im Gehalt von Proteoglycanen hin.
-
Hämatoxylin/Eosin-Farbstoffe,
die den Knochen als dunkleres Rot und die kohlenhydratreichen Knorpel
nur sehr schwach darstellen, können
auch verwendet werden. Masson-Trichrom ist im Stande, zwischen Unterschieden
im wiederhergestellten Reparaturgewebe zu unterscheiden. Knorpel-
und saure, polysaccharidreiche Reparaturgewebe, Muskel und Erythrocyten
werden rot gefärbt,
das Kollagen des Knochens wird blau gefärbt.
-
Histologische
Untersuchungen kennen auch eine Bewertung umfassen: des Glycosaminoglucangehalts
im reparierten Knorpel; der Knorpel, und Chondrocyten-Morphologie; und
der strukturellen Integrität
und Morphologie an der defekten Berührungsstelle. Die Morphologie
des reparierten Knorpels kann durch die Art an gebildetem Knorpel
identifiziert werden: artikulär
im Vergleich zu fibrotisch durch Untersuchung des Glycosaminoglycangehalts,
Grads an Knorpelablagerung und ähnliches.
-
verbleibendem
Gelenkknorpel neben dem Defekt zu bewerten. Eine solche Mikroskopie
kann unter Verwendung von Safranin O gefärbten Schnitten aus dem Defekt
durchgeführt
werden. In bestimmten Fällen erlaubt
die polarisierte Lichtmikroskopie dem Fachmann einen genaueren Betrachtung
des Reparaturvorgangs. Zum Beispiel kann unter Verwendung von Lichtmikroskopie
das reparierte Gewebe an der Peripherie eines Defekts an den verbleibenden
Knorpel als gut angelagert erscheinen. Unter Verwendung von polarisierter
Lichtmikroskopie kann jedoch beobachtet werden, dass die Kollagenfasern
des reparierten Gewebes und jene des verbleibenden Knorpels nicht
gut ineinander integriert. Das Fehlen von Faserkontinuität zwischen
repariertem und bestehendem Knorpel ist ein Hinweis auf suboptimale
Reparatur. Wenn man daher die Verbindung zwischen repariertem Knorpel
und verbleibendem, lebensfähigem
Knorpel qualitativ bewertet, wird die Faserkontinuität, wie nachstehend
beispielhaft dargestellt, vorzugsweise unter Verwendung von polarisierter Lichtmikroskopie
bewertet. (Siehe auch Shapiro et al., Journal of Bone and Joint
Surgery 75: 532-553 (1993)).
-
Die
Ausübung
der Erfindung wird durch die folgenden Beispiele noch umfassender
verstanden werden, welche hierin nur zur Illustration dargelegt
werden und nicht in irgendeiner Art als limitierend verstanden werden
sollten.
-
VI. Tierstudien: Verfahren
der Verwendung von verbesserten osteogenen Vorrichtungen
-
A. Reparatur von segmentalen
Defekten kritischer Größe unter
Verwendung von verbesserten osteogenen Vorrichtungen, die Carboxymethylcellulose
enthalten.
-
1. Experiment 1: Einheitliche
Vorrichtungskonfiguration (Hunde)
-
Diese
Studie illustriert die Wirksamkeit von OP-1 in Kombination mit Kollagenmatrix
und Carboxymethylcellulose bei der Reparatur von segmentalen Defekten
kritischer Größe der Ulna,
in dem im Fachgebiet anerkannten Hundemodell.
-
Kurz
gesagt deuten die nachstehend dargelegten Daten auf zumindest vergleichbare
röntgenografische
Heilung an den Stellen hin, welche die CMC/OP-1-Vorrichtung erhielten, im Vergleich
mit segmentalen Defekten, die mit der OP- Beispiel 20 μg/ml für jeden Antikörper, der
in 1% BSA („bovine
serum albumin";
Rinderserumalbumin) in TEST verdünnt
ist. Nach der Inkubation mit Antikörpern werden die Proben mit
TEST gespült
und in einem Bad gehalten. Ein im Handel erhältlicher Verbindungsantikörper wird
dann hinzugefügt.
Zum Beispiel können
Proben, die mit den Ziege-anti-Mensch-Kollagen Typ I- und II-Antikörpern behandelt
wurden, mit Ziege-Verbindungs-Antikörper von BioGenex Laborstories
(San Ramon, CA); Katalognummer HK209-5G) für mindestens 10 Minuten bei
Raumtemperatur inkubiert werden. Für diese mit Maus- oder Kaninchenantikörpern inkubierten
Proben kann ein Dako-LSAB2-Kit Nummer K0610 von Dako Corporation
(Carpinteria, KA), als ein Verbindungsantikörper verwendet werden. Die
Proben werden wieder mit TEST gewaschen und verbleiben in einem
Bad. Als Nächstes
wird den Proben ermöglicht,
mit Streptavidin/Alkalischer Phosphatase, die von jeder der vorstehend
identifizierten Quellen im Handel erhältlich sind, für mindestens
ungefähr
10 Minuten bei Raumtemperatur zu inkubieren. Die Proben werden dann
nochmals mit TEST gespült.
Die Proben werden dann durch Behandlung mit einer entsprechenden
Substratlösung
für ungefähr 10 Minuten
oder weniger entwickelt. Zum Beispiel werden für den Nachweis von alkalischer
Phosphatase ungefähr
100 μl 50 × Lavamesol verwendet.
Zur Farbentwicklung wird Fast Red von Dako Corporation verwendet.
Nach der Entwicklung werden die Proben durch Waschen mit Harris
Hämatoxylin
und 1 % Lithium Carbonat für
2 Minuten gegengefärbt. Die
Proben werden dann in einem wässrigen
Fixiermedium fixiert und die Knorpelbildung wird anschließend ausgewertet.
-
Färben für Typ I-
und II-Kollagen ist nützlich,
um die Grenzen zwischen regeneriertem subchondralem Knochen und
Reparaturgewebe zu bestimmen. Im Allgemeinen färbt sich Reparaturgewebe, das
fibrös
ist, weniger intensiv an. Außerdem
kann neu gebildeter subchondraler Knochen durch die Lokalisierung
von Typ II-Kollagen in kleinen Nadeln von verbleibendem Knorpel
identifiziert werden. Toluidenblau und Safranin O sind auch für die Färbung von
sauren Proteoglycanen in einer Knorpelschicht sowie in Reparaturgewebe
verwendbar.
-
2. Lichtmikroskopie mit
polarisiertem Licht
-
Mikroskopie
mit polarisiertem Licht kann verwendet werden, um Faserverzahnung
an den Übergängen zwischen
Grenzen von Reparaturgewebe und verbleibendem Gelenkknorpel neben
dem Defekt zu bewerten. Eine solche Mikroskopie kann unter Verwendung
von Safranin O gefärbten
Schnitten aus dem Defekt durchgeführt werden. In bestimmten Fällen erlaubt
die polarisierte Lichtmikroskopie dem Fachmann einen genaueren Betrachtung
des Reparaturvorgangs. Zum Beispiel kann unter Verwendung von Lichtmikroskopie
das reparierte Gewebe an der Peripherie eines Defekts an den verbleibenden
Knorpel als gut angelagert erscheinen. Unter Verwendung von polarisierter
Lichtmikroskopie kann jedoch beobachtet werden, dass die Kollagenfasern
des reparierten Gewebes und jene des verbleibenden Knorpels nicht
gut ineinander integriert. Das Fehlen von Faserkontinuität zwischen
repariertem und bestehendem Knorpel ist ein Hinweis auf sub-optimale
Reparatur. Wenn man daher die Verbindung zwischen repariertem Knorpel
und verbleibendem, lebensfähigem Knorpel
qualitativ bewertet, wird die Faserkontinuität, wie nachstehend beispielhaft
dargestellt, vorzugsweise unter Verwendung von polarisierter Lichtmikroskopie
bewertet. (Siehe auch Shapiro et al., Journal of Bone and Joint
Surgery 75: 532-553 (1993)).
-
Die
Ausübung
der Erfindung wird durch die folgenden Beispiele noch umfassender
verstanden werden, welche hierin nur zur Illustration dargelegt
werden und nicht in irgendeiner Art als limitierend verstanden werden
sollten.
-
VI. Tierstudien: Verfahren
der Verwendung von verbesserten osteogenen Vorrichtungen
-
A. Reparatur von segmentalen
Defekten kritischer Größe unter
Verwendung von verbesserten osteogenen Vorrichtungen, die Carboxymethylcellulose
enthalten.
-
1. Experiment 1: Einheitliche
Vorrichtungskonfiguration (Hunde)
-
Diese
Studie illustriert die Wirksamkeit von OP-1 in Kombination mit Kollagenmatrix
und Carboxymethylcellulose bei der Reparatur von segmentalen Defekten
kritischer Größe der Ulna,
in dem im Fachgebiet anerkannten Hundemodell.
-
Kurz
gesagt deuten die nachstehend dargelegten Daten auf zumindest vergleichbare
röntgenografische
Heilung an den Stellen hin, welche die CMC/OP-1-Vorrichtung erhielten, im Vergleich
mit segmentalen Defekten, die mit der OP- Standardvorrichtung behandelt wurden.
Der endgültige
röntgenegrafische
Grad (Maximum = 6,0) für
die mit CMC/OP-1 behandelten Defekte war 5,33 ± 0,58 verglichen mit 4,67 ± 0,58
für den Defekt,
der OP-1-Standardvorrichtung erhielt. Im Allgemeinen war die neue
Knochenbildung in allen Defekten so zeitig wie 2 Wochen nach der
Operation in allen Defekten offensichtlich. Der neue Knochen hat
sich bis zur Tötung,
zwölf Wochen
nach der Operation, fortdauernd verdichtet, verfestigt und neu geformt.
Die durchschnittliche Belastung bis zum Versagen des mit der CMC/OP-1-Vorrichtung
behandelten Defekts war 59,33 N ± 26,77. Das waren 70% der
durchschnittliche Belastung bis zum Versagen der kontralateralen
Seiten, welche die OP-1-Standardimplantate erhielten. Histologisch
waren das Endvolumen, die Qualität
und der Umformungsgrad mindestens äquivalent zu den Defekten,
die mit der CMC/OP-1 und Standard OP-1-Vorrichtung behandelt wurden,
obwohl eine Variation der endgültigen
neuen Knochenbildung und der Umformungsgrad im Vergleich von einem
Tier zum anderen vermerkt wurde. Der durchschnittliche histologische
Grad für
Defekte, die mit der CMC/OP-1-Vorrichtung behandelt wurden, war
12,67 ± 1,04
von 16 möglichen
Gesamtpunkten. Der durchschnittliche histologische Grad für die mit
der OP-1-Standardvorrichtung behandelten Defekte war 11,41 ± 0,95
von 16 möglichen
Gesamtpunkten.
-
Beschreibung der Testvorrichtung
-
Wie
schon beschrieben, bestanden Standardvorrichtungen aus rekombinantem
menschlichem osteogenem Protein-1 (rhOP-1) vermischt mit Rinderknochen-Typ
I-Kollagenmatrix bei einem Verhältnis
von 2,5 mg rhOP-1 pro Gramm an Kollagenmatix. Die verbesserte Vorrichtung
bestand aus rhOP-1 gemischt mit Rinderknochen-Typ I-Kollagenmatrix
und Carboxymethylcellulose (CMC). Die einheitlichen Vorrichtungen
wurden in sterilen Röhrchen
bereitgestellt.
-
Wie
vorher beschrieben, hat die gegenwärtig bevorzugte CMC-enthaltende
Vorrichtung für
offene Defekte eine Kitt-Konsistenz. Die einheitlichen CMC/OP-1-Vorrichtung wurde
trocken in eine kleine Schüssel
gegeben und mit Salzlösung
gemischt. Der Praktiker mischte und formte die Vorrichtung unter
Verwendung der Finger in die allgemeine Form des Defekts und platzierte
die Vorrichtung dann in die Defekt-Stelle. Es wurde berichtet, dass
die verbesserte Vorrichtung leichter gehandhabt und geformt werden
konnte und nicht an den Operationshandschuhen klebte. Die Vorrichtung
behielt ihre Integrität
bei, wenn sie während
der Spülung
und während/nach
dem Zunähen
in die Defekt-Stelle platziert wurde.
-
Experimentelle Anordnung
-
Männliche
ausgewachsene Mischlingshunde wurden aufgrund ihrer gut bekannten
Knochenreparatur- und Umformungseigenschaften benützt. Alle
Tiere waren mindestens zwei Jahre alt und wogen 40 bis 50 Pfund.
Alle Tiere wurden durch Martin Creek Kennels, USDA-Nummer 71-B-108,
Willowford, AK bereitgestellt. Spezielle Aufmerksamkeit wurde der
Auswahl von Tieren mit einheitlicher Größe und einheitlichem Gewicht geschenkt,
um die Variabilität
in Knochengeometrie und- Belastung
zu beschränken.
Die Tiere wurden vor der Operation röntgenografisch durchmustert,
um richtige Größe und Skelettreife
sicherzustellen sowie dass keine offensichtlichen ossalen Abnormalitäten vorlagen.
-
Insgesamt
wurden 3 erwachsene männliche
Hunde benützt.
Bilaterale, 2,5 cm lange segmentale Ulnadefekte wurden erzeugt.
Alle Defekte der rechten Seite erhielten die verbesserte Vorrichtung
(CMC/OP-1-Vorrichtung). Alle Defekte der linken Seite erhielten
OP-1-Standardvorrichtung. Zweimal pro Woche wurden Röntgenbilder
gemacht, um das Fortschreiten der Heilung zu untersuchen und auf
einer Skala von 0-6 bewertet. Bei der Tötung wurden alle Ulnae im Ganzen
entnommen und jene, die nach händischer
Manipulation genügend
geheilt waren, wurden mechanisch in der Drehbelastung getestet.
Die Segemente wurden durch Histologie auf Gewebereaktion, Knochenarchitektur
und -Umbau untersucht und die Qualität und die Menge an neuer Knochenbildung
und -Heilung bewertet; die Einteilung wurde auf einer Skala von
0-16 durchgeführt.
-
Operation
-
Unter
Verwendung von aseptischen Standardtechniken wurde die Operation
unter Halothangas-Anestäsie
durchgeführt.
Ein lateraler Einschnitt von ungefähr 4,0-cm-Länge
wurde durchgeführt
und die Freilegung der Ulna wurde unter Verwendung von stumpfer
und scharfer Zergliederung erhalten. Ein segmentaler osteoperiostealer
Defekt von 2,5 cm wurde in der mittleren Ulna unter Verwendung einer
oszillierenden Säge
erzeugt. Dieser Defekt betrug etwa das 2-2,5-fache des Durchmessers
des mittleren Schaftes und stellt einen Defekt von kritischer Größe dar,
d.h. der Defekt würde
spontan nicht heilen. Intraoperative Messungen wurden von dem entfernten
Knochensegment durchgeführt.
Der Radius wurde für
mechanische Stabilität
beibehalten, es wurde aber keine interne oder externe Fixierung
verwendet. Die Stelle wurde mit Salzlösung ausgespült, um Knochentrümmer sowie
herausgelaufene Markzellen zu entfernen. Nachdem die Stelle getrocknet war
und Homöostase
erreicht wurde, wurden die Implantate vorsichtig in die Defekte
platziert. Die Weichgewebe wurden in Schichten sorgfältig geschlossen,
um das Implantat zu beinhalten. Die Prozedur wurde dann auf der
kontralateralen Seite wiederholt.
-
Röntgenaufnahmen
-
Röntgenbilder
der vorderen Extremitäten
wurden zweimal wöchentlich,
bis acht Wochen nach Operation erhalten und dann wieder bei zwölf Wochen
nach der Operation bei der Tötung.
Standardisierte Bestrahlungszeiten und -Intensitäten wurden verwendet und Sandsäcke wurden
verwendet, um die Extremitäten
in einer einheitlichen Weise zu positionieren. Die Röntgenbilder
wurden beurteilt und mit früheren
Röntgenbildern verglichen,
um die Qualität
und Geschwindigkeit der Defektheilung abzuschätzen. Die Einteilung der Röntgenbilder
war in Übereinstimmung
mit der folgenden Skala: TABELLE
5 Röntgenografische
Einteilungsskala
-
Tötung
-
Am
Ende der Untersuchungszeit wurden die Tiere unter Verwendung einer
intravenösen
Barbituratüberdosis
getötet.
Die Ulna und der Radius wurden sofort im Ganzen entnommen und in
mit Salzlösung
getränkte
Windeln platziert. Beide Ulnae wurden Markophotographiert und Kontaktröntgen mit
Markierungen wurden gemacht. Die Weichgewebe wurden vorsichtig von
der defekten Stelle weg präpariert.
Eine mit Wasser gekühlte
Säge wurde
verwendet, um die Ulna in eine einheitliche Läge von 9 cm zu zerschneiden,
mit der defekten Stelle in der Mitte der Testprobe zentriert.
-
Mechanische Untersuchung
-
Sofort
nach dem Schneiden wurden die Proben unter Verwendung von Routineverfahren
auf einer hydraulischen MTS-Testmaschine mit geschlossenem Kreislauf
(Minneapolis, MN), die mit Schlagsteuerung bei einer konstanten
Verdrängungsrate
von 50 mm/min betrieben wurde, auf Versagen in der Drehbelastung
getestet, wenn die Verheilung durch manuelle Manipulation als ausreichend
erachtet wurde. Kurz gesagt wurde jedes Ende des Knochensegmentes
in einer zylindrischen Aluminiummanschette befestigt und mit Methylmethacrylat
zementiert. Ein Ende wurde starr fixiert und das andere gegen den
Uhrzeigersinn rotiert. Da die Hundeulna eine leichte Krümmung aufweist,
wurden die Proben befestigt, um die Rotation der Proben koaxial
mit dem der Testvorrichtung zu halten. Die Drehkraft wurde mit einem
Hebelarm von 6 cm durch ein servo-hydraulisches Material-Testsystem
ausgeübt.
Gleichzeitige Aufnahmen wurden von Implantatverschiebungen gemacht,
wie gemessen durch das Wegsteuergerät der Maschine, während die
Belastung aus der Belastungszelle aufgenommen wurde. Kraft-Winklerverschiebungskurven
wurden hergestellt, durch welche das Drehmoment und die Winkeldeformation
bis zum Versagen erhalten wurden, und die Energieabsorption bis
zum Versagen wurde als die Fläche
unter der Belastungs-Verschiebungskurve
berechnet.
-
Histologie
-
Die
einzelnen Proben wurden durch Eintauchen in 10% gepufferter Formalinlösung sofort
nach der mechanischen Untersuchung oder in ungetesteten Proben nach
der Schnitterzeugung fixiert. Auf einer wassergegkühlten Diamantensäge wurden
die Proben durch Schnitt entlang der Längsachse der Proben geteilt. Dieser
Vorgang resultierte in zwei Teilen von jeder Probe für unterschiedliche
histologische Präparationen,
einschließlich
nicht entkalkten, geschliffenen Schnitten und entkalkten Mikrotomschnitten.
-
Nach
der Fixierung wurden die Proben, welche für nicht-entkalkte Schnitte
vorgesehen waren, in graduierten Ethylalkohollösungen von 70% bis 100% dehydratisiert.
Die Proben wurden dann in Methylmethacrylat-Monomer gelegt und die
Polymerisierung wurde ermöglicht.
Die geschliffenen Schnitte wurden durch Schneiden der Proben auf
einer wassergekühlten
Mark V CS600-A (Grandby, CT) Hochgeschwindigkeits-Schnittsäge in Schnitte
von ungefähr
700 bis 1.000 μm
Dicke geschnitten. Die Schnitte wurden auf Acrylobjektträgern befestigt
und unter Verwendung eines metallurgischen Schleifrades zu einer
Dicke von 100 μm geschliffen,
und Mikroröntgenbilder
wurden unter Verwendung von standardisierten Techniken hergestellt. Nach
den Mikroradiografiebildern wurden die Schnitte weiter auf ungefähr 50 μm geschliffen
und mit basischem Fuchsin und Toluidinblau für die histologische Einteilung
gefärbt,
welche die folgenden Parameter der Reparatur bewertete: Qualität der Vereinigung,
Aussehen und Qualität
der kortikalen Knochens und der Spongiosa, die Anwesenheit von Knochenmarkselementen,
Knochenumformung und Entzündungsreaktion.
Die Einteilung der histologischen Parameter erfolgte in Übereinstimmung
mit der folgenden Skala: TABELLE
6 Histologische
Graduierungsskala


-
Ergebnisse
-
Röngtenografische Bewertung
-
In
dieser Untersuchung gab es keine wesentlichen Unterschiede in den
röntgenografischen
Knochenheilungseigenschaften der Stellen, welche eine CMC/OP-1-Vorrichtung
erhielten, verglichen mit segmentalen Defekten, welche die OP-1-Standardvorrichtung
erhielten. Im Allgemeinen war die neue Knochenbildung in allen Defekten
so früh
wie 2 Wochen nach der Operation offensichtlich. Der neue Knochen
verdichtete sich weiter, verfestigte sich und formte sich bis zur
Tötung
zwölf Wochen
nach der Operation um. Neue Kortexentwicklung mit früher medullärer Hohlraumbildung
trat zwischen den Bewertungen der 6. und 8. Woche auf. Der endgültige röntgenografische
Grad für
Defekte, die mit CMC/OP-1-Vorrichtung behandelt wurden, war 5,33 ± 0,58. Der
endgültige
röntgenografische
Grad für
Defekte, welche Standard-OP-1-Vorrichtung erhielten, war 4,67 ± 0,58.
-
Als
ein Beispiel sind die spezifischen repräsentativen Beobachtungen für eines
der Testtiere wie nachstehend dargelegt:
-
Rechter Defekt (CMC/OP-1-Vorrichtung)
-
Zwei
Wochen nach der Operation waren Spuren an röntgendichtem Material im rechten
Defekt vorhanden, aber der Defekt war nicht ganz überbrückt oder
mit neuem Knochen gefüllt.
Vier Wochen nach der Operation war die Menge und Röntgendichte
des neuen Knochens erheblich vermehrt. Der Defekt war überspannt,
aber der neue Knochen war noch nicht gut eingebunden. Es gab eine
geringe Konsolidierung von neuem Knochen entlang der periostalen
Ränder.
Eine äquivalente
Menge an neuem Knochen hatte sich im Vergleich mit dem linken Defekt
dieses Tieres gebildet. Sechs Wochen nach der Operation erhöhte sich
die Röntgendichte
des neuen Knochens und der Defekt war ganz überspannt und mit beträchtlichem
neuem Knochen gefüllt.
Frühe Umformung
war offensichtlich, wobei die Knochenenden des Wirtes begannen,
neuen Knochen einzubauen. Acht Wochen nach der Operation wurde neuer
Knochen weiter umgebildet und das Volumen des neuen Knochens besser
an die Defektgrenzen angenähert.
In die Knochenenden des Wirts wurde unter Verdichtung des neuen
Knochens entlang der Ränder
neuer Knochen eingebaut, was auf neue Kortexbildung hinwies. Es
gab keinen röntgenologischen
Beweis für
irgendein verbleibendes Trägermaterial.
Bei der Tötung
war eine röntgendurchsichtige
Region innerhalb des Zentrums der rechten Defektseite vorhanden,
aber Verdichtung der neuen Knochengrenzen deutete auf neue Kortexbildung
hin. Der endgültige
röntgenologische
Grad war 5 von möglichen
6 Punkten.
-
Linker Defekt (OP-1-Vorrichtung)
-
Zwei
Wochen nach der Operation waren Spuren von röntgendichtem Material in den
Defekten vorhanden, aber die Defekte waren nicht überbrückt oder
mit neuem Knochen gefüllt.
Vier Wochen nach der Operation hat sich die Menge und Röntgendichte
des neuen Knochen wesentlich erhöht
und der Defekt war überspannt
und mit neuem Knochen gefüllt.
Sechs Wochen nach der Operation war die Röntgendichte des neuen Knochens
erhöht
und der Defekt ganz überspannt
und umfassend mit neuem Knochen gefüllt. Frühe Umformung war offensichtlich
und das neue Knochenvolumen war besser an die Defektgrenzen angenähert. Der neue
Knochen war einheitlich dicht und die Knochenenden des Wirts begannen
eingeschlossen zu werden. Acht Wochen nach der Operation wurde neuer
Knochen weiter umgeformt und die Knochenenden des Wirts waren eingeschlossen
und Verdichtung des neuen Knochens hatte entlang der Defektgrenzen
begonnen. Bei der Tötung
wies die Verdichtung des neuen Knochens entlang der Defektgrenzen
auf frühe
Umformung der neuen Kortiexes hin. Die Dichte des neuen Knochens
innerhalb des Zentrums des Defekts war größer als der neue Knochen, der
sich im Defekt der rechten Seite gebildet hatte, obwohl es in der
röntgenografischen
Erscheinung an den rechten und linken Seiten in diesem Tier keine
wesentlichen Unterschiede gab. Der endgültige röntgenografische Grad war 5
von möglichen
6 Punkten.
-
Grobe Beobachtungen
-
Sowohl
rechte als auch linke Proben von allen Tieren wiesen ein ähnliches
grobes Aussehen auf. In zwei Tieren waren die rechten und linken
Defekte waren fest vereinigt und wiesen ungefähr das gleiche Volumen an neuem
Knochen auf. In einem dritten Tier hatten sowohl die rechte als
auch die linke Seite ein ähnliches,
neues Knochenvolumen, aber die linke Seite war nicht vollkommen
vereinigt.
-
Mechanische Untersuchung
-
Die
durchschnittliche Belastung bis zum Versagen von Defekten, die mit
CMC/OP-1-Vorrichtung behandelt wurden, war 59,33 N ± 26,77
(n = 3). Die durchschnittliche Belastung bis zum Versagen war 79%
der durchschnittlichen Belastung bis zum Versagen der kontralateralen
Seiten, welche die OP-1-Standardvorrichtungen
erhielten. Das stellte 91% der Festigkeit der vorher getesteten,
intakten Kontrollen dar. Die durchschnittliche Winkeldeformation
war 38,22 ± 0,69
Grad. Die durchschnittliche absorbierte Energie bis zum Versagen
war 97,47 ± 47,21
Nm Grad.
-
Die
durchschnittliche Belastung bis zum Versagen der mit der OP-1-Standardvorrichtung
behandelten Defekte war 75,39 N ± 1,88 (n = 2). Das stellte
115% der Festigkeit von vorher getesteten, intakten Kontrollen dar.
Die mittlere Winkeldeformation war 59,06 ± 27,80 Grad. Die durchschnittliche
absorbierte Energie bis zum Versagen war 93,40 ± 17,49 Nm Grade. Wie erwähnt, wurde
ein mit der OP- 1-Standardvorrichtung
behandelter Defekt aufgrund von großer Instabilität nicht
untersucht.
-
Histologie
-
Im
Allgemeinen wurde normale Knochenbildung, die mit den mit der Standard-rhOP-1-Vorrichtung
mit einer Kollagenmatrix behandelten Defekten übereinstimmte, beobachtet.
Sowohl Endvolumen als auch Qualität und Umformungsgrad waren
im Vergleich von CMC/OP-1-Vorrichtungen und OP-1-Standardvorrichtungen äquivalent.
Eine Variation in der endgültigen,
neuen Knochenbildung und des Umformungsgrades wurde in Vergleichen
von Tier zu Tier beobachtet. Der durchschnittliche, histologische
Grad für
Defekte, die mit der CMC/OP-1-Vorrichtung behandelt wurden, war
12,67 ± 1,04
aus 16 möglichen
Gesamtpunkten. Der mittlere histologische Grad für Defekte, die mit der OP-1-Standardvorrichtung
behandelt wurden, war 11,41 ± 0,95
aus einer Gesamtzahl von 16 möglichen
Punkten.
-
Im
Allgemeinen waren sowohl die linken als auch die rechten Defekte
von einem großen
Volumen an neuem Knochen überspannt.
Der neue Knochen hatte begonnen, sich neu zu organisieren, und hatte
lamellare Eigenschaften. Entlang der Defektgrenzen wurde der neue
Knochen dichter, wobei neue Kortiexe angedeutet wurden. In bestimmten
Fällen
war die Umformung auf der linken und rechten Seite nicht einheitlich
fortgeschritten. Das Volumen an neuem Knochen war in bestimmten
Fällen
auf der linken Seite etwas geringer als auf der rechten Seite. In
der Mitte aller Defekte war die Wiederkehr von medullaren Komponenten
offensichtlich.
-
Zusammenfassend
wurden verbesserte osteogene Vorrichtungen (einheitliche Konfiguration)
verwendet, um segmentale Defekte von kritischer Größe zu reparieren.
Die Raten der endochondralen Knochenreparatur, Indizien für mechanische
Stärke,
röntgenografische
Indizien und histologische Indizien deuteten an, dass verbesserte
Vorrichtungen in der Reparatur von Defekten resultierte, die zumindest
mit osteogenen Standardvorrichtungen vergleichbar sind.
-
2. Experiment 2: OP-1
Dosierungsreaktion unter Verwendung von nicht einheitlichen Vorrichtungskonfigurationen
(Hunde)
-
Diese
Studie zeigt ferner die Wirksamkeit der osteogenen Standard-Vorrichtung, die
mit Carboxymethylcellulose (CMC) gemischt ist unter Verwendung von
sowohl Standard als auch niedrigen OP-1-Dosierungsformulierungen,
um große
segmentale Defekte von kritischer Größe in dem segmentalen Ulna-Defektmodell in
Hunden zu heilen.
-
Wie
nachstehend im Detail beschrieben, wurden in dieser Studie verschiedene
Dosierungen von OP-1 angewandt. Kurz gesagt wurden die niedrigen
Dosisformulierungen der OP-1-Vorrichtung ohne CMC bei der Induktion
der neuen Knochenbildung als wirkungsvoll befunden, aber weniger
wirksam als die OP-1-Vorrichtung
mit Standarddosierung. Die mit der CMC-enthaltenden Vorrichtung
mit der niedrigen Dosierung behandelten Defekte zeigten jedoch unerwartet
frühere
und größere Volumina
an neuer Knochenbildung, verglichen mit der OP-1-Vorrichtung mit
niedriger Dosierung ohne CMC. Die Standard- oder OP-1-Vorrichtung
mit niedriger Dosis wurde durch Vereinigen von 1 g OP-1-Vorrichtung
mit 3,2 ml steriler Salzlösung
erzeugt. Die Standard- oder Niedrigdosierungs-OP-1-Vorrichtung,
die CMC enthält,
wurde durch Vereinigen von 1 g OP-1-Vorrichtung mit 0,2 g CMC und
ungefähr
2 ml steriler Salzlösung
erzeugt. Die Vorrichtungen wurden intra-operativ erzeugt. Im Röntgenbild
hatten die mit OP-1 in Standard-Dosis behandelten Stellen, mit und
ohne CMC ähnliches
röntgenografisches
Aussehen. Die mit OP-1 in Standard-Dosis behandelten Stellen hatten
frühere
und größere Volumina
an neuer Knochenbildung, verglichen mit den Stellen von niedriger
Dosierung. Histologische Ergebnisse zeigten weiter fortgeschrittene
segmentale Knochendefektheilung an den Stellen, die mit der CMC-enthaltenden
Vorrichtung behandelt wurden, verglichen mit der OP-1-Standardvorrichtung.
Die Stellen, die mit niedrigen Dosierungen der OP-1-Vorrichtung behandelt
wurden, die CMC enthielt, erreichten einen äquivalenten Grad an Umformung
und Einbau in den Wirtsknochen im Vergleich mit den Stellen, die
mit der Standard-Dosierungs-OP-1-Vorrichtung behandelt wurden, aber
das Volumen des neuen induzierten Knochens war geringer. Defekt-Stellen,
die mit Standarddosierungsvorrichtung behandelt wurden, die CMC
enthielt, erreichten die größte durchschnittliche
Drehbelastung bis zum Versagen zwölf Wochen nach der Operation,
verglichen mit allen anderen Behandlungsgruppen (61,91 ± 35,37
N, 95% der Drehstärke
von intakten Kontrollen). Die Drehstärke der Stellen der CMC enthaltenden
Niedrigdosis-Vorrichtung, war ähnlich
der der OP-1-Standardvorrichtung,
welche 78% der Stärke
von intakten Ulnae und 99% der Stärke von vorher getesteten Stellen
aufwies, die mit der Standardvorrichtung behandelt wurden. Im Gegensatz
dazu war die Drehstärke
von Niedrig-Dosierungs-OP-1-Stellen
ohne CMC nur 44% der Drehstärke
von intakten Ulnae und 56% von vorher getesteten segmentalen Defekten,
die mit der Standard-OP-1-Vorrichtung behandelt wurden.
-
Testmaterial
-
Die
Standard-OP-1-Vorrichtung (bezeichnet als OP in Tabelle 11) bestand
aus rekombinantem menschlichem osteogenem Protein-1 (rhOP-1), gemischt
mit Rinderknochen-Typ I Kollagenmatrix bei einem Verhältnis von
2,5 mg rhOP-1/g Kollagenmatrix. Eine CMC-Vorrichtung (Standarddosis,
bezeichnet als OP-1/CMC, OPCMC in Tabelle 11) bestand aus einer
OP-1-Vorrichtung, kombiniert mit Carboxymethylcellulose. Die Niedrig-Dosierungs-OP-1-Vorrichtung
bestand aus 1,25 mg rhOP-1/g Kollagenmatrix (in Tabelle 10 als LOP
bezeichnet). Jede OP-1-Vorrichtung
in sowohl Standard als auch Niedrig-Dosierung bestand aus 1 g der Vorrichtung,
die getrennt von CMC verpackt war. CMC war mit 200 mg pro Röhrchen gepackt.
Das steht im Gegensatz zu der vorstehend beschriebenen einheitlichen
Vorrichtung, worin CMC gemeinsam mit den anderen Komponenten der
Kollagenmatrix und des osteogenen Proteins verpackt war.
-
Versuchsansatz
-
Insgesamt
wurden 12 ausgewachsene Mischlingshunde verwendet. Bilateral wurden
2,5 cm segmentale Ulna-Defekte von kritischer Größe erzeugt. Die Defekte der
rechten Seite von sechs Tieren erhielten die Standard-OP-1-Vorrichtung.
Die Defekte der linken Seite dieser Gruppe erhielt die Standard-Dosierungs-OP-1/CMC-Vorrichtungen. Die
zweite Gruppe von sechs Tieren erhielt die OP-1-Vorrichtungen mit
niedriger Dosierung in die Defekte der rechten Seite und erhielten
die OP-1/CMC-Vorrichtungen
mit niedriger Dosierung in die Defekte der linken Seite. Zweimal
wöchentlich
wurden Röntgenbilder
gemacht, um das Fortschreiten der Heilung zu untersuchen. Bei der
Tötung
wurden alle im Ganzen entfernt und mechanisch in der Torsion getestet.
Ulnasegmente wurden histologisch auf Gewebereaktion, verbleibendes
Implantat und Qualität
und Menge der neuen Knochenbildung und- Heilung bewertet.
-
Tiermodell
-
Wie
vorstehend beschrieben, wurden ausgewachsene Mischlingshunde aufgrund
ihrer anatomischen Größe und bekannten
Knochenreparatur- und- Umformungseigenschaften
verwendet. Alle Tiere waren vom Skelett her ausgewachsen und wogen
von 35 bis 50 Pfund.
-
Operation
-
Unter
Verwendung von chirurgischen Techniken, ähnlich jenes die vorstehend
beschrieben wurden, wurde ein lateraler Einschnitt von ungefähr 4 cm
Länge gemacht
und die Freilegung der Ulna wurde unter Verwendung von stumpfer
und scharfer Präparation
erhalten. Ein 2,5 cm segmentaler osteoperiostealer Defekt wurde
in der Mitte der Ulna unter Verwendung einer oszillierenden Säge erzeugt.
Dieser Defekt betrug etwa das 2-2,5-fache des Durchmessers des mittleren
Schaftes und stellte einen Defekt von kritischer Größe dar, d.h.
der Defekt würde
spontan nicht heilen. Intraoperative Messungen wurden von dem entfernten
Knochensegment durchgeführt.
Die Länge
des Segments, die zwei äußeren Durchmesser
und der zentrale Durchmesser des Segments wurden in Millimetern
in den chirurgischen Aufzeichnungen festgehalten. Der Radius wurde für mechanische
Stabilität
beibehalten. Die Stelle wurde mit Salzlösung ausgespült, um Knochentrümmer sowie
herausgelaufene Markzellen zu entfernen. Nachdem die Stelle getrocknet
war und Homöostase
erreicht war, wurden die Implantate vorsichtig in die Defekte platziert.
Die Weichgewebe wurden in Schichten geschlossen, um das Implantat
zu enthalten. Der Vorgang wurde dann auf der kontralateralen Seite
wiederholt.
-
Röntgenaufnahmen
-
Wie
vorstehend beschrieben, wurden Röntgenbilder
der Vorderextremitäten
zweimal wöchentlich
bis acht Wochen nach der Operation erhalten und dann wieder bei
der Tötung
bei zwölf
Wochen nach der Operation.
-
Tötung
-
Vorgehensweisen
waren ähnliche
jenen, die vorstehend beschrieben wurden. Am Ende der Untersuchungsperiode
wurden die Tiere getötet,
die Ulna und der Radius sofort im Ganzen entnommen und in Windeln platziert,
die mit Salzlösung
getränkt
waren. Weichgewebe wurden vorsichtig von der Defektstelle wegpräpariert.
-
Eine
Bandsäge
wurde verwendet, um die Ulna in eine einheitliche Länge von
9 cm zu schneiden, mit der Defekt-Stelle in der Mitte der Testprobe
gelegen.
-
Mechanische Untersuchung
-
Die
Protokolle waren ähnlich
jenen die vorstehend beschrieben wurden. Kurz gesagt wurden Proben auf
einer hydraulischen MTS-Testmaschine mit geschlossenem Kreislauf
(Minneapolis, MN) die mit Schlagkontrolle bei einer konstanten Verdrängungsrate
von 50 mm/min betrieben wurde, bis zum Versagen in der Drehbelastung
getestet. Die Drehbelastung wurde mit einem Hebelarm von 6 cm durch
ein servohydraulisches Material-Testsystem ausgeübt. Gleichzeitige Aufzeichnungen
wurden von Implantatverschiebung gemacht, wie gemessen durch das
Wegsteuergerät
der Maschine, während
die Belastung aus der Belastungszelle aufgezeichnet wurde. Kraft-Winkel-Verschiebungskurven
wurden erzeugt, aus welchen das Drehmoment und die Winkeligdeformation
bis zum Versagen erhalten wurde, und die Energieabsorption bis zum
Versagen wurde als die Fläche
unter der Belastungs—Verschiebungskurve
berechnet.
-
Histologie
-
Wie
vorstehend beschrieben, wurden fixierte Proben, die für nicht-entkalkte
Schnitte vorgesehen waren, in graduierten Ethylalkohollösungen von
70% bis 100% dehydratiert. Die Proben wurden dann in Methylmethacrylat-Monomer
gelegt und die Polymerisierung ermöglicht. Die geschliffenen Schnitte
wurden durch Schneiden der Proben auf einer wassergekühlten Hochgeschwindigkeits-Schnittsäge in Schnitte
von ungefähr 700
bis 1.000 μm
Dicke geschnitten. Diese Schnitte wurden auf Acrylobjektträgern befestigt
und auf eine Dicke von 100 μm
geschliffen. Nach der Mikroradiografie wurden die Schnitte weiter
auf ungefähr
50 μm geschliffen und
mit basischem Fuchsin und Toluidinblau für die histologische Einteilung
gefärbt,
welche die folgenden Parameter der Reparatur bewertete: Qualität der Vereinigung,
das Aussehen und die Qualität
des kortikalen Knochens und der Spongiosa, die Anwesenheit von Knochenmarkselementen,
Knochenumformung und Entzündungsreaktion.
-
Röntgenografische Bewertung
-
Zwölf Wochen
nach der Operation (Tötung)
erzielten die Standarddosierungs-OP-1/CMC-Stellen
die höchsten
durchschnittlichen röntgenografischen
Grade, 5,17/6,0 Punkte. Der endgültige
röntgenografische Grad
für die
OP-1-Standardvorrichtungen
war 5,00/6,0. Die OP-1-Stellen mit niedrigen Dosierungen hatten
einen durchschnittlichen endgültigen
röntgenografischen
Grad von 3,83/6,0. Op-1/CMC-Stellen mit niedriger Dosierung hatten
einen durchschnittlichen Grad von 4,67/6,0. Zu allen Zeitpunkten
hatten die Standarddosierungs-OP-1/CMC-Stellen höhere röntgenografische Grade als die
OP-1-Standardvorrichtung ohne CMC. Zu allen Zeitpunkten hatten die
OP-1/CMC-Stellen mit niedriger Dosierung höhere mittlere röntgenografische
Grade als die OP-1-Stellen mit niedriger Dosierung ohne CMC.
-
Statistische
Analyse zeigte einen erheblichen Effekt für den Implantattyp, wenn alle
röntgenografische Grade
zusammengefasst wurden (Kruskal-Wallis Einwegsanalyse der Varianz,
p = 0,0049). Mehrfache Vergleiche zeigten, dass die durchschnittlichen
röntgenografische
Grade von Standard-OP-1 und OP-1/CMC- Vorrichtungen mit Standard-Dosierung
für alle
Zeitperioden erheblich höher
waren als die Niedrig-Dosierungs-OP-1-Stellen ohne CMC (bei α= 0,10 bzw.
bei α =
0,05). Mehrfache Vergleiche zeigten auch, dass der durchschnittliche
röntgenografische
Grad der Standarddosierungs-OP-1/CMC-Stellen erheblich höher war
als der von Niedrig-Dosierungs-OP-1/CMC-Stellen (α = 0,10).
Allerdings, und unerwarteterweise, waren die durchschnittlichen
röntgenografischen
Grade der Standard-Dosierungs-OP-1-Vorrichtungen
nicht erheblich höher
als die durchschnittlichen röntenografischen
Grade für
die Niedrig-Dosierungs-OP-1/CMC-Stellen.
-
Niedrig-Dosierungs-OP-1-Stellen
ohne CMC
-
Zwei
Wochen nach der Operation war neue Knochenbildung in einem der sechs
Defekte offensichtlich, die mit Niedrig-Dosierungs-OP-1 behandelt
wurden. Spuren an röntgendichtem
Material war um den Defekt vorhanden, aber neuer Knochen überbrückte oder überspannte
den Defekt nicht. Der durchschnittliche röngenografische Grad zwei Wochen
nach der Operation war 0,17/6,0 Punkte. Vier Wochen nach der Operation zeigte
die gleiche Stelle, die nach zwei Wochen neue Knochenbildung zeigte,
eine Erhöhung
an neuem Knochenvolumen. Vier Defekte waren überspannt und ein Defekt war
bei vier Wochen mit neuem Knochen gefüllt. Zwei Stellen zeigten vier
Wochen nach der Operation wenig Aktivität. Der durchschnittliche röntgenografische Grad
bei vier Wochen war 1,83/6,0. Sechs Wochen nach der Operation waren
zwei Stellen, die mit Niedrig-Dosierungs-OP-1 behandelt waren, mit
neuem Knochen überspannt
und gefüllt.
Zwei Seiten waren überspannt, aber
nicht ganz mit neuem Knochen gefüllt.
Ein Tier zeigte eine etwas zeitige neue Knochenbildung. Ein Tier hat
keine neue Knochenbildung gezeigt. Der durchschnittliche röntgenografische
Grad nach sechs Wochen war 2,83/6,0. Von sechs bis acht Wochen war
keine zusätzliche,
neue Knochenbildung offensichtlich, aber eine geringe Verdichtung
des neuen Knochens war offensichtlich und eine geringe frühe Umformung
hatte stattgefunden. Der durchschnittliche röntgenografische Grad bei acht
Wochen war 3,17/6,0. Bei der Tötung
zwölf Wochen
nach der Operation zeigten alle Defekte etwas gut enthaltenen neuen
Knochen, aber die Dichte war erheblich geringer als die der umgebende
Wirtsknochen. Gelegentlich waren Strahlendurchlässigkeiten bei den Übergängen von
Wirtsknochen/neuen Knochen vorhanden. Der durchschnittliche röntgenografische
Grad bei zwölf
Wochen war 3,83/6,0.
-
Niedrig-Dosierung OP-1/CMC-Stellen
-
Zwei
Wochen nach der Operation war in drei von sechs Defekten, die mit
Niedrig-Dosierungs-OP-1/CMC behandelt wurden, frühe, neue Knochenbildung offensichtlich.
Neuer Knochen überspannte oder
füllte
die Defekte nicht, war aber innerhalb der chirurgischen Stellen
gut enhalten. Der durchschnittliche röntgenografische Grad bei zwei
Wochen war 0,83/6,0. Vier Wochen nach der Operation war neue Knochenbildung
in fünf
von sechs Defekten vorhanden, welche die Defekte überspannte
und fast füllte.
Der durchschnittliche röntgenografische
Grad bei vier Wochen war 2,33/6,0. Bei sechs Wochen erhöhte sich
die Dichte des neuen, in den Defekten vorhandenen Knochens. Frühe Inkorporation
in dem Wirtsknochens waren in drei der sechs Defekte offensichtlich.
Ein Tier zeigte bilateral bei sechs Wochen keine neue Knochenbildung.
Der durchschnittliche röntgenografische
Grad zu dieser Zeit war 3,00/6,0. Von sechs bis acht Wochen fand
keine neue Knochenbildung statt. Frühe Umbildung und Inkorporation
in den Wirtsknochen waren offensichtlich. Ein Tier zeigte keine
Veränderungen
der Erscheinung. Der durchschnittliche röntgenografische Grad bei acht
Wochen war 3,33/6,0. Unerwartet zeigten die OP-1/CMC-Stellen mit
niedriger Dosierung umfangreichere neue Knochenbildung und -Umformung
als die OP-1-Stellen mit niedriger Dosierung ohne CMC. In Stellen,
in welchen der Defekt mit neuem Knochen komplett gefüllt war,
war die Dichte des neuen Knochens geringer als die des umgebenden
Wirtsknochens. Der durchschnittliche röntgenografische Grad bei zwölf Wochen
(Tötung) war
4,67/6,0.
-
Standard OP-1-Vorrichtungsstellen
-
Die
Ergebnisse in dieser Studie stimmten mit allen früheren Studien
der Standard-OP-1-Vorrichtung überein.
Zwei Wochen nach der Operation zeigten vier von sechs mit der OP-1-Vorrichtung
behandelten Defekte frühe,
neue Knochenbildung. In zwei Defekten überspannte umfangreicher neuer
Knochen die Defekte, aber neuer Knochen füllte die Defekte nicht aus.
Insgesamt war der neue Knochen nicht gut enthalten. Der durchschnittliche
röntgenografische
Grad bei 2 Wochen war 1,50/6,0. Vier Wochen nach der Operation fand in
allen sechs Defekten eine Erhöhung
in der Menge und Dichte von neuem Knochen statt. Neuer Knochen überspannte
alle Defekte. In vier der sechs Stellen schien der Defekt vollständig mit
neuem Knochen gefüllt
zu sein. Der durchschnittliche röntgenografische
Grad bei vier Wochen war 3,00/6,0. Sechs Wochen nach der Operation
war die Dichte des neuen Knochens erhöht. Der neue Knochen war nicht
gut in dem verbleibenden Defekt enthalten. Im Allgemeinen wurde
frühe Inkorporation
an den Wirtsknochenenden in drei der sechs Stellen beobachtet. Der
durchschnittliche röntgenografische
Grad nach sechs Wochen war 3,67/6,0. Von sechs bis acht Wochen war
in drei der sechs Stellen fast vollständige Inkorporation in den
Wirtsknochen offensichtlich, obwohl in allen Defekten Umformung
in Richtung der Ulna-Umrisse stattgefunden hatte. Der durchschnittliche
röntgenografische
Grad bei acht Wochen war 4,50/6,0. Zwölf Wochen nach der Operation
(Tötung)
hatte erhebliche Umformung stattgefunden, obwohl das neue Knochenvolumen
noch nicht den Ulna-Umrissen entsprach. Neuer Knochen dehnte sich
oft in das umgebende Gewebe aus, obwohl eine geringe Neubildung
von Kortexen in allen Defekten offensichtlich war, die mit Standard-OP-1-Vorrichtung
behandelt wurden. Der durchschnittliche röntgenografische Grad bei zwölf Wochen
war 5,00/6,0.
-
Standard-Dosis-OP-1/CMC-Stellen
-
Zwei
Wochen nach der Operation war frühe,
neue Knochenbildung in vier der sechs mit der OP-1/CMC-Vorrichtung
behandelten Defekte offensichtlich. Neuer Knochen war nur in einem
der vier Defekte gut enthalten. Neuer Knochen schien zwei der sechs
Defekte zu überspannen
und zu füllen.
Der durchschnittliche röntgenografische
Grad bei zwei Wochen war 1,67/6,0. Vier Wochen nach der Operation
war erheblicher neuer Knochen in allen sechs Defekten entstanden.
Der neue Knochen war nicht gut enthalten, aber frühe Inkorporation
in den Wirtsknochen wurde an zwei Stellen beobachtet. Der durchschnittliche
röntgenografische Grad
bei vier Wochen war 1,67/6,0. Von vier bis sechs Wochen fand in
allen Defekten erhebliche Umbildung und Inkorporation in den Wirtsknochen
statt. Neuer Knochen war nicht gut enthalten, aber neuer Knochen
im Weichgewebe begann zu resorbieren. Der durchschnittliche röntgenografische
Grad bei sechs Wochen war 4,33/6,0. Bei acht Wochen wurde in zwei
Stellen komplette Inkorporation in den Wirtsknochen wahrgenommen und
frühe neue
Kortexbildung war an mindestens einer Stelle offensichtlich. Der
durchschnittliche röntgenografische
Grad bei acht Wochen war 4,67/6,0. Bei zwölf Wochen nach der Operation
(Tötung)
wiesen drei von sechs Defekten erhebliche Inkorporation in die Wirtskochenenden
auf. Neuer Knochen war noch immer außerhalb des Defekts vorhanden,
obwohl beträchtliche
Umformung stattgefunden hatte. Der durchschnittliche röntgenografische
Grad bei zwölf
Wochen war 5,17/6,0.
-
Grobe Beobachtungen
-
Stellen,
die mit Implantaten mit niedriger Dosierung mit und ohne CMC behandelt
wurden, zeigten weniger neues Knochenvolumen, verglichen mit den
OP-1-Stellen mit
hoher Dosierung mit und ohne CMC. Alle Hochdosierungsstellen waren
grob gesehen fest vereinigt, aber drei der zwölf Stellen, die mit Nierdrig-Dosierungs-OP-1 behandelt wurden,
waren bei der Tötung
noch nicht fest vereinigt.
-
Niedrig-Dosierungs-OP-1-Stellen
ohne CMC
-
In
allen Fällen
hat die Menge an neuem, gebildetem Knochen das ursprüngliche
Defektvolumen nicht überstiegen.
Die neue Knochenbildung war gut enthalten, obwohl der Knochen in
zwei von sechs Segmenten nicht ganz vereinigt war.
-
Niedrig-Dosierungs-OP-1/CMC-Stellen
-
Ähnlich zu
den Defekten, die mit Niedrig-Dosierungs OP-1 behandelt wurden,
war die neue Knochenbildung gut enthalten. Eine von sechs mit Niedrig-Dosierungs
OP-1/CMC behandelten Stellen war nicht ganz vereinigt. Üblicherweise
war das neue Knochenvolumen geringer als das ursprüngliche
Defektvolumen.
-
Standard-OP-1-Vorrichtungsstellen
-
Ähnlich zu
früheren
Studien war das neue Knochenvolumen, in Stellen, die mit der Standard-OP-1-Vorrichtung
behandelt wurden, zwei- bis dreimal größer als das ursprüngliche
Defektvolumen. Alle Defekte waren fest vereinigt. In fünf von sechs
Defekten dehnte sich beträchtlicher,
neuer Knochen in das Weichgewebe aus und war mit dem Radius verbunden.
In einem Defekt war das Volumen des neuen, gebildeten Knochens geringer
als an den anderen Stellen.
-
Standard-Dosierungs-OP-1/CMC-Stellen
-
Neues
Knochenvolumen in fünf
von sechs mit OP-1/CMC behandelten Defekten überschritt das ursprüngliche
Wirtsknochenvolumen und dehnte sich in das Weichgewebe aus. Das
neue Knochenvolumen war zwei- bis dreimal größer als das Volumen des ursprünglichen
Defekts. Wie vorstehend erwähnt,
wurde in einem Tier bilateral vermindertes Knochenvolumen beobachtet.
-
Mechanische Untersuchungen
-
Zusammenfassungen
der mechanischen Untersuchungen scheinen in Tabellen 7 und 8.
-
Unerwartet
erhielten zwölf
Wochen nach der Operation die mit der Standard-Dosierungs-OP-1/CMC-Vorrichtung behandelten
Defektstellen die größte durchschnittliche
Drehbelastung bis zum Versagen, verglichen mit allen anderen Behandlungsgruppen,
einschließlich
der Standardvorrichtungsgruppe. Die durchschnittliche Belastung
bis zum Versagen war 61,91 ± 35,37
N (n = 6). Das stellt 95% der Drehfestigkeit von früher getesteten,
intakten Ulnae dar und 121% der Stärke von früher getesteten segmentalen
Defekten, die mit der OP-1-Standardvorrichtung
behandelt wurden. Die mit der OP-1-Standardvorrichtung behandelten
Stellen hatten eine durchschnittliche Drehfestigkeit von 55,84 ± 37,26
N (n = 6), 86% der vorher getesteten intakten Kontroll-Ulnae und
110% der vorher getesteten segmentalen Defekte, die mit der OP-1-Vorrichtung behandelt
wurden. Die durchschnittliche Belastung bis zum Versagen für die Niedrig-Dosierungs-OP-1/CMC-Stellen war
50,66 ± 31,68
N (n = 5) oder 78% der Festigkeit der intakten Kontroll-Ulnae und 99%
der Festigkeit von früher
getesteten segmentalen Defekten, die mit der OP-1-Standardvorrichtung
behandelt wurden. Die durchschnittliche Belastung bis zum Versagen
für die
Niedrig-Dosierungs-OP-1-Stellen war 28,72 ± 14,71 N (n = 4). Das stellte
44% der Drehfestigkeit von früher
getesteten, intakten Kontroll-Ulnae dar und 56% der früher getesteten
segmentalen Defekte, die mit der OP-1-Standardvorrichtung behandelt
wurden.
-
Unerwartet
zeigten gepaarte t-Test der Belastung bis zum Versagen innerhalb
der Tiere eine erhebliche Wirkung für Implantatarten, wenn die
Niedrig-Dosierungs-OP-1-Standardvorrichtungen
mit Niedrig-Dosierungs-OP-1/CMC-Vorrichtungen (p = 0,0597) verglichen
wurden. Die gepaarte durchschnittliche Belastung für Niedrig-Dosierungs-OP-1-Stellen
war 28,72 ± 14,71
(4). Die gepaarte durchschnittliche Belastung bis zum Versagen für die Niedrig-Dosierungs-OP-1/CMC-Stellen
war 62,89 ± 18,47
(4). Es wurde in gepaarten t-Tests kein erheblicher Unterschied
der durchschnittlichen Belastung bis zum Versagen in Standard-OP-1-Vorrichtungen, verglichen
mit der durchschnittlichen Belastung bis zum Versagen in Standard-Dosierungs-OP-1/CMC-Vorrichtungen
gefunden.
-
-
-
Histologie
-
Unerwartet
erzielten die mit der Standard-Dosierungs-OP-1/CMC-Vorrichtung behandelten
Stellen die höchste
durchschnittliche histologische Punktezahl, 12,08/16,0 Punkte. Die
Niedrig-Dosierungs-OP-1/CMC-Stellen erzielten eine Punktezahl von
11,07/15,0, etwas höher
als die durchschnittliche histologische Punktezahl für die Standard-OP-1-Vorrichtungsstellen,
10,88/16,00. Der durchschnittliche histologische Grad für die Niedrig-Dosierungs-OP-1-Stellen
war 9,58/16,0 Punkte.
-
Die
statistische Analyse der durchschnittlichen histologischen Grade
durch die Behandlungsgruppe zeigte einen signifikanten Effekt für den Implantattyp
(Kruskal-Wallis-Einwegsanalyse
der Varianz, p = 0,0282). Mehrfache Vergleiche der Gruppendurchschnitte
zeigten, dass der durchschnittliche Gesamtgrad für die Standard-Dosierungs-OP-1/CMC-Stellen
erheblich höher
war als für
die Stellen mit Niedrig-Dosierungs-OP-1 ohne CMC (bei α = 0,05).
-
Statistische
Analyse des Qualitätsgrads
der Vereinigung zeigte auch einen signifikanten Effekt für den Implantattyp.
Unerwartet war der durchschnittliche Qualitätsgrad der Vereinigung für die Standard-Dosierungs-OP-1
CMC-Stellen (3,5/4,0) wieder erheblich höher als für die Niedrig-Dosierungs-OP-1-Stellen
(2,0/4,0 bei α =
0,05). Es wurden für
den Implantattyp keine signifikanten Unterschiede gefunden, wenn
die durchschnittlichen Grade für
die Kortexentwicklung, verbleibendes Implantat und entzündliche
Reaktion verglichen wurden.
-
Niedrig-Dosierungs-OP-1-Stellen
ohne CMC
-
Neue
Knochenbildung war in allen, mit dem Niedrig-Dosierungs OP-1 behandelten
Defekten offensichtlich, aber die Menge an neuem Knochen innerhalb
des Defekts hat den Defekt oft nicht ausgefüllt und war mit den Knochenenden
des Wirts nicht durchgehend. In einer Stelle war der Defekt histologisch
ganz vereinigt. Neuer Knochen war in den frühen Stadien der Organisation
und der Umformung. Manche Gebiete von neuem, mineralisiertem Knochen
waren auch offensichtlich.
-
Niedrig-Dosierungs-OP-1/CMC-Stellen
-
Die
Niedrig-Dosierungs OP-1/CMC-Stellen hatten ein ähnliches histologisches Erscheinungsbild
verglichen mit den Niedrig-Dosierungs-OP-1-Stellen. Allerdings und
unerwartet war der neue Knochen häufiger durchgehend mit dem
Wirtsknochen in den Niedrig-Dosierungs-OP-1/CMC-Stellen, verglichen
mit den Niedrig-Dosierungs-OP-1-Stellen.
In Fällen,
in denen der Knochen durchgehend mit dem Wirtsknochen war, war frühe Umformung
und Verdichtung der neuen Knochengrenzen offensichtlich. In Fällen, in
denen neue Knochenheilung nicht vollständig war, waren Gebiete von
neu mineralisiertem Knochen offensichtlich, sowie auch Gebiete von
fibrösem
Geweben innerhalb des Defekts. Im Allgemeinen war der neue Knochen
gut enthalten. Einige Bereiche fortgeschrittener Umformung entlang
der Defektgrenzen wurden beobachtet.
-
Standard-OP-1-Vorrichtungsstellen
-
Umfangreiche,
neue Knochenbildung überbrückte alle
Defekte. Frühe
Verdichtung der neuen Knochengrenzen hatte stattgefunden. In manchen
Fällen
verbanden sich Bereiche von neu mineralisiertem Knochen mit Bereichen
von reifem Knochen. In der Mitte der Defekte waren gelegentlich
kleine Bereiche von verbleibendem Trägermaterial vorhanden. Keine
entzündliche
Reaktion wurde beobachtet. Neuer Knochen breitete sich oft in die
Weichgewebe aus. Umformung war an den Grenzen von Defekt/neuem Knochen
am fortgeschrittensten. Der Knochen hatte sich in diesen Bereichen
zu einer lamellaren Struktur umgeformt.
-
Standard-Dosierungs-OP-1/CMC-Stellen
-
Es
gab keine merklichen Unterschiede in der histologischen Erscheinung
zwischen den Standard-OP-1-Stellen und den Standard-Dosierungs-OP-1/CMC-Stellen. Beträchtlicher,
neuer Knochen überspannte
und füllte
die Defekte. Die erheblichste Umformung fand an den neuen Knochen/Wirtsknochengrenzen
statt. Der umgeformte Knochen hatte in diesen Bereichen eine lamellare
Struktur. Verdichtung von neuen Kortexen war offensichtlich, aber
noch nicht vollständig.
Gelegentlich wurden kleine Mengen an eingeschlossenem verbleibendem
Trägermaterial
beobachtet, das durch neue Knochenbildung umgeben war. Es gab keine
damit in Zusammenhang stehende entzündliche Reaktion.
-
Ergebnis
-
Verbesserte
osteogene Vorrichtungen induzierten unerwartet frühere und
größere Volumina
an neuer Knochenbildung bei niedrigeren Dosierungen von OP-1, als
sie durch Standardvorrichtungen bei niedrigen Dosierungen von OP-1
induziert wurden. Darüber
hinaus und unerwartet erzielten Defektstellen, die mit verbesserten
osteogenen Vorrichtungen behandelt wurden, die höchste Drehbelastung bis zum
Versagen zwölf
Wochen nach der Operation. Histologisch erzielten die verbesserten
Vorrichtungen unerwartet die höchste
durchschnittliche Punktezahl und zeigten häufiger durchgehenden neuen
Knochen mit dem Wirtsknochen.
-
B. Reparatur von segmentalen
Defekten mit nicht kritischer Größe unter
Verwendung von osteogenen Vorrichtungen, welche Carboxymethylcellulose
enthalten
-
1. Experiment 1: Zeitverlauf
der Reparatur von geschlossenen Defekten, die mit einer einheitlichen
Vorrichtung behandelt wurden (Hunde)
-
Diese
Studie an einer Lücke
von nicht kritischer Größe wurde
durchgeführt,
um injizierbare Konfigurationen der verbesserten osteogenen Verbindungen
zu untersuchen. Dieser Untersuchungsaufbau verwendete die 3-mm-Lücke beim
4-Wochen-Modell.
Diese Studie untersuchte die Heilung des Defekts nach der Injektion von
OP-1/CMC/Kollagenmatrixkonfiguration. Der kontralaterale Vorderlauf
von jedem Tier war eine Kontrolle. Außerdem wurde ein Zeitverlauf
der Heilung für
einen unbehandelten Defekt bei 4, 8 und 12 Wochen bewertet.
-
Die
Details des verwendeten Protokolls werden nachstehend zusammengefasst.
-
Testsystem
-
Ausgewachsene
Mischlingshunde (18), die für
den Zweck gezüchtet
wurden, wurden in dieser Studie aufgrund ihrer anatomischen Größe und bekannten
Knochenreparatur- und -Umformungscharakteristika benützt. Die
Tiere waren zu Beginn der Studie ungefähr 2 bis 4 Jahre alt und wogen
20 bis 30 kg (ungefähr).
Die Tiere wurden röntgenografisch
durchmustert, um die richtige Größe und Reife
des Skeletts sicherzustellen, sowie, dass keine offensichtlichen
ossalen Abnormalitäten
bestanden.
-
Testmaterialbeschreibung
-
Verbesserte
osteogene Vorrichtungs-Formulierungen, die rekombinantes menschliches
osteogenes Protein-1 (rhOP-1) in einer Kollagenmatrix, vermischt
mit CMC, enthielten, wurden untersucht. Kontrollen bestanden aus
der Scheinvorrichtung alleine.
- Formulierung 1: 0,350 mg
rhOP-1 in 100 μl
CMC-Gel (7%) m/o Kollagenmatrix
- Formulierung 2: 0,350 mg rhOP-1 in 100 μl Acetat/Lactosepuffer
- Formulierung 3: 0,350 mg rhOP-1 in 170 mg Kollagen-CMC-Matrix,
befeuchtet mit Salzlösung
- Kontrolle 1: 0 mg rhOP-1 in 100 μl Gel
- Kontrolle 2: 0 mg rhOP-1 in 100 μl Acetat/Lactosepuffer
- Kontrolle 3: 0 mg rhOP-1 in 170 mg Kollagen-CMC-Matrix, befeuchtet
mit Salzlösung
-
Versuchsansatz
-
Bilateral
wurden segmentale 3-mm Ulnadefekte in allen Tieren erzeugt. Neun
Tiere erhielten eine der drei experimentellen Testformulierungen
im Defekt der rechten Seite, sodass drei Stellen von jeder Art untersucht
werden konnten. In den linken Defekt wurde eine Scheinvorrichtung
implantiert. Diese Tiere wurden vier Wochen nach der Operation getötet. Die
verbleibenden neun Tiere erhielten bilateral Defekte ohne Implantat und
wurden nach Perioden von 4, 8 und 12 Wochen getötet (drei zu jedem Zeitpunkt).
Wie vorstehend besprochen, wurden Röntgenbilder gemacht, um den
Fortschritt der Heilung zu untersuchen. Eine endgültige Bestimmung
der Tötungsdaten
der neun Tiere, die rhOP-1-Formulierungen erhielten, basierte auf
den wöchentlichen Röntgenbildern.
Bei der Tötung
wurden alle Ulnae im Ganzen entnommen und mechanisch auf Drehbelastung untersucht.
Die Segmente wurden, wie vorstehend beschrieben, durch histologisch
auf Gewebereaktion und die Qualität und Menge an neuer Knochenbildung
und Ausmaß an
Heilung bewertet.
-
Unter
Verwendung von chirurgischen Standard-Techniken wurde ein lateraler
Einschnitt von ungefähr zwei
Zentimetern Länge
gemacht und die Freilegung der Ulna wurde unter Verwendung von stumpfer
und scharfer Zergliederung erhalten. Der 3-mm-Defekt wurde in der
rechten mittleren Ulna unter Verwendung einer oszillierenden Säge erzeugt.
Der Radius wurde für
mechanische Stabilität
beibehalten, aber es wurde keine interne oder externe Fixierung
verwendet. Die Weichgewebe wurden sorgfältig in Schichten um den Defekt verschlossen.
Die rhOP-1-Probe
oder Scheinvorrichtung wurde dann entsprechend des Behandlungsplans
in die Stelle injiziert. Der Vorgang wurde dann auf der kontralateralen
Seite mit der entsprechenden Probe wiederholt.
-
Röntgenaufnahmen
der Vorderextremitäten
wurden wöchentlich
bis sechs Wochen nach der Operation und dann zweimal wöchentlich
bis 12 Wochen von überlebenden
Tieren erhalten. Eine zusätzliche
Röntgenaufnahme
wurde von den verbleibenden Tieren bei der Tötung zwölf Wochen nach der Operation
erhalten. Die Röntgenbilder
wurden durch den Forscher auf einer Einteilungsskala von 0-6 eingestuft
und mit früheren Röntgenbildern
verglichen, um die Qualität
und Geschwindigkeit der Defektheilung abzuschätzen.
-
Untersuchungsverfahren
-
Wie
vorstehend besprochen, wurden die Tiere zu den vorgesehenen Zeiten
getötet
und die Ulna und der Radius wurden sofort im Ganzen geerntet. Beide
Ulnae wurden makrophotographiert und es wurden Kontaktröntgenbilder
gemacht. Weichgewebe wurden sorgfältig von der Defektstelle wegpräpariert.
Eine wassergekühlte
Säge wurde
verwendet, um die Ulna in eine einheitliche Länge von 9 cm zu schneiden,
mit der Defektstelle in der Mitte der Testprobe zentriert. Sofort
nach dem Schneiden wurden die Proben auf einer hydraulischen MTS-Testmaschine
mit geschlossenem Kreislauf (Minneapolis, MN), wie vorstehend beschrieben,
auf Drehbelastung bis zum Versagen getestet.
-
Sowohl
getestete als auch nicht-getestete Proben wurden, wie schon vorstehend
beschrieben, für
histologische Bewertung hergestellt. Nach Mikro-Röntgenografie
wurden die Schnitte weiter auf ungefähr 50 μm geschliffen und mit basischem
Fuchsin und Toluidinblau für
histologische Untersuchung der Parameter der Reparatur gefärbt, einschließlich: der
Qualität
der Vereinigung, dem Aussehen und der Qualität des kortikalen Knochens und
der Spongiosa und der entzündlichen
Reaktion.
-
Beschreibende
Statistiken von mechanischer Testung, röntgenografischer Einteilung
und Histologie wurden bewertet, um die Heilung zu charakterisieren.
-
Ergebnisse
-
Die
folgenden Beobachtungen und repräsentativen
Daten wurden bis jetzt gesammelt (4 Wochen nach der Operation):
Zusammenfassungen
der mechanischen Untersuchungen erscheinen in den Tabellen 9, 10
und 11. Tabelle 11 ist eine Zusammenfassung der Kontrollindividuen
in früheren,
nicht in Beziehung stehenden Experimenten. Im Allgemeinen und insgesamt
deuten die Ergebnisse dieser Studie darauf hin, dass Tiere, die
mit OP-1 behandelt wurden, beschleunigte Heilung zeigen. Die mit
OP-1 behandelten Defekte heilten in einem Drittel bis zur Hälfte der
Zeit von nicht behandelten Kontrollen. Außerdem und unerwartet resultierte
die CMC/OP-1/Kollagenformulierung in besserer Knocheneingrenzung
als es in der Abwesenheit von CMC beobachtet wurde. Diese Beobachtungen
wurden mechanisch, röntgenografisch
sowie histologisch bestätigt.
-
Schlussfolgerung
-
CMC-enthaltende
osteogene Vorrichtungen (injizierbare Konfiguration) können zur
Reparatur von segmentalen 3-mm Ulnadefekten von nicht kritischer
Größe an einer
geschlossenen Defektstelle verwendet werden.
-
-
-
-
2. Experiment 2: Beschleunigte
Reparatur einer geschlossenen Frakturdefekts, behandelt mit einer
einheitlichen Vorrichtung (Hunde)
-
Das
Folgende ist eine vergleichende experimentelle Studie der Wirksamkeit
von injizierbaren, CMC-enthaltenden rhOP-1-formulierungen zur Beschleunigung
der Frakturheilung in Hunden.
-
Testsystem
-
Ausgewachsene,
männliche,
für diesen
Zweck gezüchtete
Mischlingshunde wurden in dieser Studie benützt. Besondere Aufmerksamkeit
wurde der Auswahl von Tieren mit einheitlicher Größe und einheitlichem Gewicht
geschenkt, um die Variabilität
in Knochengeometrie und -Belastung einzuschränken. Die Tiere wurden klinisch
und röntgenografisch
durchmustert, um akute und chronische medizinische Zustände während einer zweiwöchigen Quarantänezeit auszuschließen.
-
Die
Operation wurde unter Verwendung von aseptischen Standard-Techniken
unter Isofluorangas-Anestäsie
durchgeführt
und wurde über
Monitore für
Elektrokardiogramm und Herzfrequenz überwacht. Voroperative Medikamente
wurden ungefähr
20-30 Minuten vor der Anästhesieinduktion
verabreicht. Die voroperativen Medikamente bestanden aus Atropin
(Dosierung 0,02 mg/Pfd. Körpergewicht)
und Acepromizin (Dosierung 0,1 mg/Pfd. Körpergewicht). Anästhesie
wurde durch intravenöse
Injektion von Natriumpentothal bei einer Dosierung von 5,0 mg/Pfd.
Körpergewicht
verabreicht. Nach der Induktion wurde eine endotracheale Röhre gesetzt
und die Anästhesie
wurde durch Isofluoraninhaltion aufrechterhalten. Beide Vorderextremitäten wurden
präpariert
und in steriler Weise abgedeckt. Es wurde ein lateraler Einschnitt
von ungefähr
zwei Zentimeter Länge
gemacht und die Freilegung der Ulna wurde unter Verwendung von stumpfer
und scharfer Präparation
erhalten. Der 3,0-mm-Defekt von nicht kritischer Größe wurde
in der mittleren Ulna unter Verwendung einer oszillierenden Säge gemacht.
Der Radius wurde für
mechanische Stabilität
beibehalten und keine interne oder externe Fixierung wurde verwendet.
Die Stelle wurde mit Salzlösung
ausgespült
und die Weichgewebe wurden in Lagen sorgfältig um den Defekt geschlossen.
Die entsprechende Implantatvorrichtung wurde gemäß dem Behandlungsplan in die
Defektstelle injiziert.
-
Der
Vorgang wurde dann auf der kontralateralen Seite mit dem entsprechenden
Implantat wiederholt.
-
Acepromizin
(0.75cc/50Pfd. Körpergewicht)
und Butorphanol-Tartrat (0,025mg/Pfd. Körpergewicht) wurde wie benötigt postoperativ
verabreicht. Antibiotika wurden für vier Tage nach der Operation
intramuskulär an
die Tiere verabreicht und anteriore-posteriore Routine Röntgenaufnahmen
wurden sofort nach der Operation gemacht, um die ordentliche operative
Platzierung sicherzustellen. Die Tiere wurden in 3 × 4-Fuß Aufwachkäfigen gehalten,
bis sie ihr Gewicht tragen konnten, danach wurden sie in Ausläufe transferiert,
wo ihnen uneingeschränkte
Bewegung ermöglicht
wurde.
-
Röntgenbilder
der Vorderextremitäten
wurden unter Verwendung von standardisierten Belichtungszeiten und
-Intensitäten
wöchentlich
bis vier Wochen und dann in überlebenden
Tieren zweimal in der Woche bis 16 Wochen erhalten. Die Röntgenbilder
wurden ausgewertet und mit früheren
Röntgenbildern
verglichen, um Qualität
und Schnelligkeit der Defektheilung abzuschätzen. Die Veränderungen
in der röntgenografischen
Erscheinung wurden basierend auf Anwesenheit und Dichte der neuen
Knochenbildung, Ausmaß von
Defektüberbrückung und
Inkorporation in die Wirtsknochen-Kortexes bewertet.
-
Testmaterial-Beschreibung
-
Die
Implantatmaterialien bestanden aus rekombinantem menschlichem osteogenem
Protein-1 (rhOP-1) in einer Acetatpufferformulierung und rhOP-1
in CMC-Kollagen. Die rhOP-1-Formulierungen wurden mit Kontrollen
verglichen, die nur Träger
enthielten. Die Acetatpuffer-rhOP-1-Formulierungen bestanden aus 3,5
mg/ml OP-1 in einem Lactose/Acetatpuffer, verabreicht in einem 100-μl-Volumen.
Die Trägerkontrolle
bestand aus einem 100-μl-Volumen
von Lactose/Acetatpuffer. Die rhOP-1/CMC-Kollagen-Formulierungen
bestanden aus 0,35 mg rhOP-1 in 170 mg CMC-Kollagenmatrix, benetzt
mit ungefähr
0,43 ml Salzlösung,
und hatte die Konsistenz einer Paste. Das Kontroll-CMC-Kollagen
bestand aus 170 mg CMC-Kollagenmatrix,
benetzt mit ungefähr
0,43 ml Salzlösung,
und wurde auch in 100 μl
injizierbarem Volumen verabreicht.
-
Versuchsaufbau
-
Insgesamt
wurden 36 ausgewachsene Mischlingshunde benützt. Bilaterale segmentale
Ulnadefekte, 3,0 mm in Länge,
wurden in allen Tieren erzeugt. 14 Tiere erhielten eine Injektion
von 0,35 mg rhOP-1/Acetatpufferformulierung in einem Defekt und
den Acetatpuffer ohne rhOP-1 in den kontralateralen Defekt. 9 Tiere erhielten
eine Injektion von 0,35 mg rhOP-1/CMC-Kollagenformulierung in einen
Defekt und CMC-Kollagen alleine in den kontralateralen Defekt. Die
23 Tiere wurden nach der Dauer von 4, 8 und 12 Wochen nach der Operation
getötet.
13 Hunde erhielten bilaterale Defekte ohne Implantat (Defekt alleine)
und wurden nach der Dauer von 4, 8, 12 und 16 Wochen nach der Operation
bewertet.
-
Untersuchungsverfahren
-
Am
Ende der Untersuchungsdauer wurden die Tiere unter Verwendung einer
intravenösen
Barbituratüberdosis
getötet.
Die Ulna und der Radius wurden sofort im Ganzen entnommen und in
mit Salzlösung
getränkte
Windeln gelegt. Beide Ulnae wurden markrophotographiert und Kontaktröntgenaufnahmen
wurden gemacht, bevor die Weichgewebe vorsichtig von der Defektstelle
wegpräpariert
wurden. Eine wassergekühlte Säge wurde
dann verwendet, um die Ulna für
biomechanische Testbewertung in eine gleichmäßige Länge von 9 cm zu schneiden,
mit dem Defekt in der Mitte der Testprobe zentriert.
-
Wenn
die Defektheilung basierend auf der manuellen Manipulation ausreichend
war, wurden die Proben in der Drehbelastung bis zum Versagen auf
einer hydraulischen MTS-Testmaschine mit geschlossenem Kreislauf
(Minneapolis, MN) getestet, die mit Wegsteuerung bei einer konstanten
Verdrängungsrate
von 50 mm/min betrieben wurde. Jedes Ende des Knochensegments wurde
in einer zylindrischen Aluminiummanschette befestigt und mit Methylmethacrylat
zementiert. Ein Ende wurde fest fixiert und das andere wurde gegen
den Uhrzeigersinn gedreht. Da die Hundeulna eine leichte Krümmung aufweist,
wurden die Proben außermittig
befestigt, um die Rotation der Proben koaxial mit der der Testvorrichtung
zu belassen. Die Drehkraft wurde mit einem Hebelarm von 6 cm ausgeübt. Kraft-Winkelverschiebungskurven
wurden hergestellt, aus welchen das Drehmoment und die Winkeldeformation
bis zum Versagen erhalten wurde, und die Energieabsorption bis zum
Versagen wurde als die Fläche
unter der Belastungs—Verschiebungskurve
berechnet wurde.
-
Sowohl
getestete als auch nicht-getestete Proben wurden für die histologische
Bewertung vorbereitet. Die einzelnen Proben wurden durch Untertauchen
in 10% gepufferter Formalinlösung
sofort nach der mechanischen Untersuchung oder nach dem Zerschneiden
von nicht getesteten Proben fixiert. Die Proben wurden auf einer
wassergekühlten
Diamantensäge
durch Zerschneiden entlang ihrer Längsachse geteilt. Dieser Vorgang
resultierte in zwei Teilen von jeder Probe für histologische Präparation,
einschließlich
nicht entkalkten, geschliffenen Schnitten und nicht entkalkten Mikrotomschnitten.
Die histologischen Schnitte wurden auf die Qualität der Vereinigung,
das Aussehen und die Qualität
der kortikalen Knochen und der Spongiosa und auf Knochenumformung
bewertet.
-
Ergebnisse
-
Grobe Beobachtungen
-
Alle
mit rhOP-1 behandelten Defekte zeigten so früh wie 4 Wochen nach der Operation
neue Knochenbildung. Alle behandelten Defekte waren manuell stabil
und mit festem neuem Knochen überbrückt, der
sich zwischen 8 und 12 Wochen nach der Operation umzuformen begann.
In manchen Defekten dehnte sich der neue Knochen über die
Defektenden und in die darüberliegenden
Weichgewebe, welche die Defekte umgaben, hinaus aus.
-
Die
meisten Kontrolldefekte waren nach der manuellen Manipulation 4
Wochen nach der Operation nicht ganz stabil, obwohl die meisten
mechanisch getestet wurden. Fasriges Gewebe war oft vorhanden und die
Defektenden blieben mit manchen Zeichen für neuen Knochen sichtbar. 12
Wochen nach der Operation waren die meisten Kontrolldefekte stabil,
mit nur gelegentlicher leichter Bewegung der Defektenden.
-
Röntgenografische Bewertung
-
In
den mit rhOP-1 behandelten Defekten wurden zwei Wochen nach der
Operation Spuren von neuem Knochen in und um die Defektstellen beobachtet.
Die Menge und Dichte des neuen Knochens erhöhte sich von 2 bis 4 Wochen,
wobei die Kortexes des Wirtsknochen begannen, verdeckt zu werden.
Zwischen 4 und 8 Wochen nach der Operation wiesen mit rhOP-1 behandelte
Defekte an den Defektenden erhebliche Mengen an röntgendichtem,
neuem Knochen sowie lateral eine Überbrückung der Defekte auf. Bei
12 Wochen waren die Wirtskortexe von röntgendichten überbrückenden
Verbindungen verdeckt.
-
Die
röntgenografische
Erscheinung der behandelten und unbehandelten Kontrolldefekte unterschied sich
erheblich von der Erscheinung der mit rhOP-1 behandelten Defekte.
Zwischen 2 und 3 Wochen nach der Operation gab es in der röntgenografische
Erscheinung im Vergleich zur postoperativen Erscheinung keine wesentlichen
Veränderungen.
Nach 4 Wochen waren in der Röntgendichte
der Defektenden des Wirtsknochens leichte Veränderungen sichtbar. Von 8 bis
12 Wochen weitete sich etwas neuer Knochen aus den endostealen Regionen
und Wirtsknochenenden aus, obwohl die Überbrückung nicht komplett war. 16
Wochen noch der Operation zeigte nur eine Hälfte der unbehandelten Kontrollen
röntgenografische
Zeichen von vollständiger
Knochendefektheilung.
-
Mechanische Untersuchung
-
Die
durchschnittlichen mechanischen Untersuchungsergebnisse durch Behandlungsgruppe
und Zeitdauer werden in den Tabellen 11A und 11B zusammengefasst.
Die Drehfestigkeit der mit rhOP-1 behandelten Defekte waren wesentlich
höher als
die von nicht-behandelten Kontrollen und nur Vehikelkontrollen und
näherten
sich an die Festigkeit von vorher getesteten intakten Ulnae an.
Die mechanische Festigkeit der rhOP-1/Acetatpuffer-Formulierungsdefekte
war 4 Wochen nach der Operation 59% der Festigkeit von intakter Ulna,
77% 8 Wochen nach der Operation und 98% 12 Wochen nach der Operation.
Die mechanische Festigkeit der rhOP-1/CMC-Kollagendefekte war 36%,
53% und 66% der intakten Festigkeit bei 4 Wochen, 8 Wochen bzw.
12 Wochen.
-
Mechanisch
hatten die Kontroll-Defektstellen bei frühen Zeitperioden wenig mechanische
Stabilität, obwohl
sich die Defektfestigkeit mit der Zeit verbesserte. Die mechanische
Festigkeit der Defekte, welche die Kontroll-Acetatpufferlösung erhielten,
lag bei äquivalenter
Zeitdauer zwischen 23% und 30% der mit rhOP-1/Acetatpuffer behandelten Defekte.
Die Kontrolldefekte hatten eine mechanische Festigkeit, die 4 Wochen
nach der Operation äquivalent
zu 16% der Stärke
von intakter Ulna war, 18% bei 8 Wochen und 29% bei 12 Wochen. Die
Defekte mit nur CMC-Kollagen waren in der mechanischen Festigkeit ähnlich zu
den Kontroll-Acetatpufferdefekten.
Die mechanische Festigkeit der unbehandelten Defekte erhöhte sich
nach der Operation von 9% bei 4 Wochen auf 70% bei 12 Wochen. Die
durchschnittliche mechanische Festigkeit bei 16 Wochen nach der
Operation verminderte sich auf 28%, was ähnlich zu der 8-Wochen-Festigkeit
von 29% war.
-
TABELLE
11A Ergebnisse
mechanischer Untersuchungen, durchschnittliche ± Standardabweichung(en)
-
TABELLE
11B Ergebnisse
mechanischer Testung in Form von Prozent von Stärke von intakter Ulna durchschnittliche ± Standardabweichung(en)
-
Histologische Bewertung
-
Die
Histologie der rhOP-1- und Kontrolldefekte korrelierte gut mit den
groben, radiografischen und mechanischen Testergebnissen. In den
rhOP-1 behandelten Defekten wurde proliferative, neue Knochenbildung beobachtet,
welche die Defekte überspannte
und sich in manchen Fällen
in das subkutane Gewebe ausdehnte. Neuer Knochen bildete sich aus
den endostalen Ulna-Regionen und aus dem Periosteum nahe den defekten
Kortexen. Die Überbrückung mit
neuem Knochen war im Allgemeinen 8 Wochen nach der Operation abgeschlossen,
obwohl Bereiche von mineralisiertem Knorpel vorhanden waren. Die
Defekte waren mit dicht gewobenem Knochen überbrückt und gefüllt und die Neuorganisation
der Wirtsknochenkortexe wurde bei 12 Wochen beobachtet.
-
Behandelte
und unbehandelte Kontrolldefekte zeigten nur Zeichen von fasriger
Gewebevereinigung mit kleinen Mengen an neuem Knochen, der sich
entlang dem lateralen Ulna-Periosteum und von der endostalen Region
4 Wochen nach der Operation gebildet hatte. Bei 8 Wochen füllte Faserknorpel
die Kontrolldefekte, wobei Bereiche von mineralisiertem Knorpel
zwischen dem neuen Knochenwachstum vorhanden war. Erhebliche Mengen
an neuem Knochen bildeten die Wirtsknochenkortexe und dehnten sich
in die Defekte aus. Defektkortexe wurden mit dichter neuer Knochenbildung
verdeckt und endochondrale Heilung war fortgeschritten, obwohl die
Vereinigung nicht vollständig
war. Bei 16 Wochen waren die Kontrolldefekte mit neuem Knochen überbrückt, wobei
einige Lücken
von mineralisierendem Knorpel vorhanden waren. Neuer Knochen dehnte
sich von den Wirtskortexe und benachbarten periostalen Gewebeschichten über den
Defekt aus.
-
Schlussfolgerung
-
Die
Ergebnisse dieser Studie zeigen, dass osteogene Proteine, die in
Defekte von nicht-kritischer Größe injiziert
werden, die Knochenheilung beschleunigen. Die lokale perkutane Injektion
von rhOP-1 in den Defekt von nicht kritischer Größe in der Hundeulna resultierte,
verglichen mit nicht behandelten und nur mit Träger behandelten Kontrolldefekten,
in einer proliferativen periostalen und endostalen neuen Knochenbildung.
Röntgenograf
resultierte die rhOP-1-Injektion in diffusen Verkalkungen von neuem
Knochen und früher
Fraktur-Kallusbildung, so zeitig wie 2 bis 3 Wochen nach der Operation,
mit erheblicher Knochenüberbrückung und
Inkorporation der Wirtskortexe bei 8 bis 12 Wochen nach der Operation.
Die mechanische Festigkeit von Defekten mit nicht kritischer Größe, die
mit rhOP-1 behandelt wurden, näherten
sich bei 12 Wochen an die Festigkeit von intakter Ulna an und war
zwei- bis dreimal so groß wie
jene, die bei der Heilung der Kontrolldefekte beobachtet wurde.
-
C. Reparatur von Frakturdefekten
unter Verwendung von verbesserten osteogenen Vorrichtungen, die
Carboxymethylcellulose enthalten
-
1. Experiment 1: Ziegen-Frakturstudie
unter Verwendung von unterschiedlichen Dosierungen an OP-1 (geschlossene
Defektstelle)
-
Das
Folgende ist eine vergleichende, randomisierte experimentelle Studie
von frischen, verschlossenen Frakturdefekten des mittleren Schafts
der Tibia (abgelenkt auf 5 mm) in Ziegen.
-
Wahl der Versuchstiere
-
Es
ist im Fachgebiet allgemein anerkannt, dass Ziegen eine mit Menschen
vergleichbare Knochenheilungsrate aufweisen. Die Ergebnisse dieser
Studie können daher
auf einen klinischen Rahmen extrapoliert werden. Es wird dem Fachmann
darüber
hinaus klar sein, dass die Knochen von Ziegen bezüglich Größe, Form
und mechanischer Belastung eine Ähnlichkeit
zu jenen von Menschen zeigen.
-
Wie
hierin offenbart und beschrieben, ist ein Tiermodell für eine geschlossene
diaphyseale Fraktur entwickelt worden. Dieses Modell fördert die
Studie von natürlicher
und beschleunigter Frakturheilung, mit oder ohne einer internen
Frakturfixierungsvorrichtung, indem es die Bildung einer reproduzierbaren
Standardfraktur der Hinterextremität erlaubt. Kurz gesagt wird
mit Hilfe einer Dreipunkt-Biegungsvorrichtung in völlig anästhesierten
Ziegen eine geschlossene Fraktur des mittleren Schafts der Tibia
erzeugt. Nach geschlossener Reduktion und Ablenkung der Fraktur
auf 5 mm wurde ein äußerer Gipsverband
angelegt. Aufgrund der Verminderung des Anschwellens der Hinterextremität wurde
der Gips zweimal wöchentlich
ersetzt, um Stabilität
beizubehalten. Nach 2 Wochen können
die Tiere die gebrochene Extremität vollständig belasten und nach 4-6
Wochen ist die Fraktur klinisch und röntgenografisch geheilt. Der
Gips wird nach 6 Wochen entfernt.
-
Die
Tiere werden von Ruiter, einem Ziegenzüchter-Spezialist (Holland),
gekauft. Zufällig
gezüchtete weibliche
Milchziegen werden verwendet werden. Um den Einfluss eines sich
entwickelnden Skeletts auf die Ergebnisse zu umgehen, werden ausgewachsene
Tiere verwendet werden. Die Tiere sind vom Skelett her ausgewachsen,
1 bis 2 Jahre alt und wiegen ungefähr 50 kg.
-
Versuchsablauf
-
Als
Prämedikation
werden Ketamin 10 mg/kg i.m. und Atropin 1,5 mg i.m (oder im Fachgebiet
anerkannte Äquivalente
der vorhergehenden Medikamente) etwa 15 Minuten vor der vollständigen Anästhesie
der Tiere verabreicht. Letztere wird mit Etomidaten (oder im Fachgebiet
anerkannten Äquivalenten
davon), 0,3 mg/kg i.v., erzielt. Nach Intubation wird die Anästhesie
mit einer O2/N2O-Mischung
(1:1, Vol./Vol.) beibehalten, die mit 1 bis 2% Isoflurane (oder
im Fachgebiet anerkannten Äquivalenten
davon) ergänzt
ist.
-
Mit
einer Dreipunkt-Biegungsvorrichtung wird auf der linken Tibia ein
Varustrauma appliziert, bis eine geschlossene Fraktur des mittleren
Schaftes erhalten wird. Die Fraktur wird dann manuell reduziert
und die Haut über
Fraktur wird rasiert. Die gesamte Hinterextremität wird für die geschlossene Verabreichung
der osteogenen Vorrichtung durch Injektion mit einer Alkohol-enthaltenden
Desinfektionslösung
jodiert, sowie um die Haut für
anschließende
Immobilisierung durch den Gipsverband zu trocknen. Die osteogene
Vorrichtung wird bei der Frakturstelle in die Nähe der Frakturlücke injiziert,
um den Kontakt mit der medullaren Kavität zu maximieren. Zum Beispiel
wird eine osteogene Vorrichtung intramedullär mit einer dicken Knochenmarks-Aspirationsnadel
injiziert. Nach der Injektion wurde zur Immobilisierung ein Gipsverband
angelegt.
-
Studienaufbau
-
Die
Tiere wurden gemäß der Behandlung
in 5 Gruppen (I-V) von 3 Tieren und 1 Gruppe (VI) von 9 Tieren geteilt:
0,5 mg OP-1 in einer injizierbaren Konfiguration der osteogenen
Vorrichtung, enthaltend mindestens OP-1, Kollagenmatrix und Bindemittel
wie zum Beispiel CMC, formuliert, wie vorstehend beschrieben (direkt
nach der Erzeugung der Fraktur)(Gruppe I), 1,0 mg OP-1 in einer
injizierbaren Vorrichtung, die mindestens OP-1, Kollagen und Bindemittel
wie zum Beispiel CMC enthält,
(direkt nach der Erzeugung der Fraktur) (Gruppe IV), 1,0 mg OP-1
in einer Standardkonfiguration der OP-1-Vorrichtung (entsprechend
0,4 Gramm OP-1-Vorrichtung),
injiziert direkt nach der Bildung der Fraktur (Gruppe V) und keine
Behandlung mit OP-1 (Gruppe VI, Kontrollen). Die Behandlungsgruppen
werden wie folgt zusammengefasst.
-
-
Die
Tiere wurden 2, 4 und 6 Wochen nach der Erzeugung der Fraktur getötet. In
den Gruppen I bis V wurde zu jedem Zeitintervall ein Tier getötet und
in Gruppe VI wurden 3 Tiere zu jedem Zeitintervall getötet. Durch
Vergleich der behandelten Gruppen mit den Kontrollen kann der beschleunigende
Effekt der Behandlung auf die Frakturheilung bestimmt werden. Information über den
OP-1-Dosierungseffekt und die Zeit der Injektion kann durch Vergleich
der Gruppe I mit Gruppe II bzw. Gruppe II mit Gruppe III erhalten
werden. Unterschiede in der Wirksamkeit zwischen unterschiedlichen
Konfigurationen werden durch Bewertung der Ergebnisse der Gruppen
II, IV und V ausgewertet.
-
In
anderen ähnlichen
Experimenten werden sich Dosierungen von osteogenem Protein wie
zum Beispiel OP-1 von ungefähr
0,125 bis 10,0 mg erstrecken. Bestimmte andere Konfigurationen von
verbesserten osteogenen Vorrichtungen werden unterschiedliche Mengen
an Bindemittel wie zum Beispiel CMC enthalten, die sich von unter
200 mg CMC/1000 mg Kollagenmatrix bis über 200 mg CMC/1000 mg Kollagenmatrix
bewegen. Benetzungsmittelvolumina werden, wie vorstehend beschrieben,
variiert werden, um die gewünschte Konsistenz/Konfiguration
an osteogener Vorrichtung zu erzielen. In noch anderen ähnlichen
Experimenten werden andere Bindemittel wie zum Beispiel Fibrinkleber
und/oder andere Matrizen wie zum Beispiel β-TCP verwendet werden.
-
Bewertung der Defektreparatur
-
Radiografie
-
Röntgenaufnahmen
werden in Anlehnung an ein standardisiertes Verfahren gemacht und
stellen die Frakturstelle in zwei Richtungen dar, antero-posterior
und mediolateral. Die ersten Röntgenbilder
werden sofort nach der Erzeugung der Fraktur gemacht und danach
zweimal wöchentlich
bis zur Tötung
der Tiere. Die Röntgenaufnahmen
zur Zeit der Tötung
werden nach der Entfernung des Gipsverbandmaterials gemacht; alle anderen
werden mit dem Gipsverbandmaterial in situ gemacht. Sie werden blind
durch zwei Radiologen oder Chirurgen qualitativ beurteilt und wenn
möglich
wird die folgende Einteilungsskala für die Bewertung des Heilungsvorgangs
angewandt:
- Grad 0: Kein Unterschied verglichen mit dem Zustand
sofort nach der Erzeugung der Fraktur
- Grad 1: Kleine Mengen von Kallus
- Grad 2: Mäßige Mengen
von Kallus
- Grad 3: Große
Mengen von Kallus
- Grad 4: Schwinden der Frakturenden
-
Spezielle
Aufmerksamkeit wird der Art der Fraktur und der Ausrichtung gezollt.
-
Computertomography
-
Nach
Entfernung der linken Hinterextremität und des Gipsverbandmaterials
und nach Aufnahme der Röntgenbilder
wurde ein CT-Scan vom Frakturgebiet gemacht. Die Weichgewebe sollten
für eine
bessere Qualität
der Scans in situ verbleiben. Reste der Frakturlücken und von Kallus können auf
diese Weise sichtbar gemacht werden. Darüber hinaus konnte die Menge
von Kallus berechnet werden. Genauere Information über den
Fortschritt des Heilungsprozesses kann, anstatt mit einfachen Röntgenbildern,
mit CT-Scans erhalten werden.
-
Biomechanische Untersuchungen
-
Nach
CT-Scannen und anschließender
Entfernung aller Weichgewebe von der Tibia werden biomechanischen
Untersuchungen durchgeführt.
Ein Verfahren für
fortgeschrittene mechanische Untersuchungen des Knochens wird wie
folgt entwickelt: Die Biegungssteife in 24 Richtungen bei Winkelzunahme
von 15° wird gemessen
und als ein Vektor in einem X-Y-Koordinatensystem dargestellt, wobei
eine Ellipse erhalten wird. Die Ellipse wird mit der einer kontralateralen,
intakten Tibia verglichen. Parameter können von diesem Vergleich abgeleitet
werden, die als Maße
der Heilungseffizienz dienen. Schließlich wird ein Dreh-Test bis
zum Versagen durchgeführt
und die Drehfestigkeit, Drehsteife, Winkelverschiebung und aufgenommene
Energie bis zum Versagen werden als der Prozentsatz der kontralateralen
gesunden Tibia ausgedrückt.
Dieser Vergleich mit der kontralateralen Tibia wird ausgeführt, um
die interindividuelle Variation zu verringern.
-
Histologie
-
Nach
der biomechanischen Untersuchung werden die Knochenfragmente mit
speziellen Ringen für
die histologische Untersuchung zusammengehalten. Standardfixierung,
Einbettungs- und Färbetechniken
für Knochen
und Knorpel werden verwendet. Spezielle Aufmerksamkeit wird den
Zeichen für
fasrige-, osteochondrale- oder knochige Vereinigung gezollt. Ein
histologisches Punktesystem wird dann angewandt, um die Menge an
Fasergewebe, Knorpel, neu gebildetem Knochen und Knochenmark in
der Frakturlücke
zu quantifizieren.
-
Untersuchungsergebnisse
-
Es
wird erwartet, dass mechanische, röntgenografische, tomographische
und histologische Daten darauf hindeuten werden, dass injizierbare
Konfigurationen von verbesserten osteogenen Vorrichtungen beschleunigte
Reparatur von geschlossenen Frakturdefekten induzieren können.
-
Schlussfolgerung
-
Verbesserte
osteogene Vorrichtungen (injizierbare Konfiguration) können verwendet
werden, um die Reparatur von frischen Frakturdefekten des mittleren
Schafts der Tibia (abgelenkt auf 5 mm) an einer geschlossenen Defektstelle
zu reparieren.
-
2. Experiment 2: Ziegen-Frakturstudien
unter Verwendung von unterschiedlichen Dosierungen an OP-1 bei unterschiedlichen
Zeiten (geschlossene Defektstelle)
-
Diese
unabhängige
Studie verwendet auch Ziegen als das Tiermodell zur Untersuchung
der Reparatur der Frakturdefekte unter Verwendung der verbesserten
osteogenen Vorrichtungen. Unter Verwendung von Techniken, die ähnlich zu
jenen der vorstehend beschriebenen waren, wurden frische, geschlossene
diaphyseale Frakturen (hauptsächlich
transvers oder einfach schief) mit Reduktion mit externer Fixierung
und Ablenkung auf 5 mm unter Verwendung der CMC-enthaltenden osteogenen
Vorrichtungen behandelt.
-
Der
Studienaufbau ist wie folgt:
-
Fünf Ziegen
werden in jeder Gruppe 2 Wochen nach der Behandlung getötet und
fünf Ziegen
in jeder Gruppe werden 4 Wochen nach der Behandlung getötet.
-
Andere ähnliche
Studien untersuchen die Reparatur von Frakturdefekten zu Zeitpunkten,
die mehr als 4 Wochen betragen und untersuchen sowohl niedrigere
als auch höhere
Dosierungen von OP-1. Außerdem wird
die Reparatur von Frakturdefekten unter Verwendung von unterschiedlichen
Gesamtmengen (mg) der CMC-enthaltenden OP-1-Vorrichtung, verabreicht
an die Defektstelle, untersucht. Eine Untersuchung nützt eine
Vorrichtung von 400 mg Gesamtgewicht, verabreicht an die Defekt-Stelle.
Noch eine andere ähnliche
Studie wird jedes der vorstehend erwähnten Bindemittel wie zum Beispiel
Fibrinkleber und/oder irgendeine der vorstehend erwähnten Matrizen
wie zum Beispiel β-TCP
nützen.
-
Die
Defektreparatur wird, wie es vorstehend genauer beschrieben ist,
unter Verwendung einer Vielzahl von klinischen Routineprotokollen,
einschließlich
Radiografie, CT-Scan, biomechanische Untersuchung und Histologie
bewertet.
-
Untersuchungsergebnisse
-
Es
wird erwartet, dass mechanische, röntgenografische, tomographische,
histologische Daten darauf hindeuten, dass injizierbare Konfigurationen
von verbesserten osteogenen Vorrichtungen die beschleunigte Reparatur
von Frakturen an einer geschlossen Defektstelle induzieren können. Es
wird auch erwartet, dass in bestimmen, bevorzugten Ausführungsformen
niedrige Dosierungen des osteogenen Proteins bei der Induktion der
Reparatur effektiv sein werden, besonders in verbesserten osteogenen
Vorrichtungen.
-
Schlussfolgerung
-
Verbesserte
osteogene Vorrichtungen (injizierbare Konfiguration) können verwendet
werden, um frische, geschlossene diaphyseale Frakturen (abgelenkt
auf 5 mm) an einer geschlossenen Defektstelle zu reparieren.
-
D. Reparatur von osteochondralen
Defekten unter Verwendung von verbesserten Osteogenen Vorrichtungen, die
Carboxymethylcellulose enthalten
-
I. Experiment 1: Osteochondralen
Defekte über
die gesamte Dicke (Hunde)
-
Eine
Studie wurde unter Verwendung des osteochondralen Propfen („plug")-Defektmodells bei Hunden durchgeführt, um
die Wirksamkeit der verbesserten osteogenen Vorrichtungen bei der
Reparatur von osteochondralen/chondralen Defekten zu zeigen. Vier
Formulierungen von Implantaten wurden bewertet, einschließlich (1)
osteogene Standard-Vorrichtung, einschließlich rhOP-1 und Kollagenmatrix,
(2) verbesserte osteogene Vorrichtung, einschließlich rhOP-1, Kollagenmatrix
und Carboxymethylcellulose (CMC)-Bindemittel, (3) nur Kollagenmatrix
oder (4) Kollagenmatrix und CMC-Bindemittel.
-
Kurz
gesagt wurden Defekte über
die gesamte Dicke mit 5 mm im Durchmesser, die sich 6 mm in den subchondralen
Knochen ausdehnten, bilateral auf dem medialen Oberschenkelcondylus
von 4 ausgewachsenen Mischlingshunden erzeugt. Ausgewachsene männliche
Mischlingshunde wurden aufgrund ihrer anatomischen Größe und Knochenreparatur-
und Umformungseigenschaften ausgewählt. Besondere Aufmerksamkeit wurde
der Auswahl von Tieren mit einheitlicher Größe und einheitlichem Gewicht
gezollt, um die Variabilität
in Knochengeometrie und Gelenkbelastung zu vermindern. Die Tiere
wurden vor der Operation röntgenografisch durchmustert,
um die richtige Größe und Skelettreife
sicherzustellen, sowie dass keine offensichtlichen ossalen Abnormalitäten bestanden.
Die Defekte der linken Seite erhielten osteogene Standard-Vorrichtung
in zwei Tieren und die verbesserte osteogene Vorrichtung in den
anderen beiden Tieren. Die Defekte der rechten Seite erhielten Matrix
alleine in einem Tier, ein Matrix/Bindemittelgemisch in einem Tier
und wurden in den verbleibenden zwei Tieren nicht behandelt.
-
Beschreibung der Testvorrichtung
-
Die
osteogene Standard-Vorrichtung bestand aus rhOP-1, gemischt mit
Rinder-Typ I-Knochenkollagenmatrix (2,5 mg rhOP-1/g Matrix). Die
verbesserte osteogene Vorrichtung bestand aus 100 mg der OP-1/Kollagenmatrix-
osteogenen Standard-Vorrichtung, kombiniert mit 20 mg CMC (gesamt
120 mg). Die Kontrollen bestanden aus Rinder-Typ I-Knochenkollagenmatrix
alleine und der Kollagenmatrix mit CMC. Beide wurden in 100-mg-Mengen
bereitgestellt.
-
Studienaufbau
-
Der
Studienaufbau wird in Tabelle 12 zusammengefasst.
-
Tabelle
12: Reparatur von osteochondralen Defekten in Hunden unter Verwendung
von OP-1
-
Operation
-
Unter
Verwendung von aseptischen Techniken wurde die Operation unter Isofluorangas
Anästhesie durchgeführt. Anästhesie
wurde durch intravenöse
Injektion von Natrium-Pentothal bei einer Dosierung von 5,0 mg/Pfd.
Körpergewicht
verabreicht. Ein medialer parapatellarer Einschnitt von ungefähr vier
Zentimeter Länge
wurde gemacht. Die Patella wurde lateral zurückgezogen, um den Oberschenkelcondylus
freizulegen. Eine 5-mm-Bohrspitze mit einer speziell entworfenen
Manschette, um Bohren des Defekts über eine Tiefe (6 mm) zu verhindern
wurde verwendet,, um den endgültigen
Defekt zu erzeugen. Sterile Salzlösung wurde zu der verbesserten
osteogenen Vorrichtung hinzugefügt
und genau vor der Implantation gemischt. Nach der Spülung des
Defekts mit Salzlösung
zur Entfernung von Knochentrümmern
und ausgelaufenen Markzellen wurde die entsprechende Vorrichtung
unter Verwendung einer stumpfen Sonde in die Defekt- Stelle gepackt. Genug
Vorrichtung wurde in den Defekt platziert, sodass er bündig mit
der gelenkbildenden Oberfläche
war. Die Gelenkskapsel und die Weichgewebe wurden dann in Schichten
geschlossen. Der Vorgang wurde auf der kontralateralen Seite mit
dem entsprechenden Implantat wiederholt.
-
Bewertung und abschließende Verfahren
-
Osteochondrales
Verheilen wurde, wie nachstehend beschrieben, grob und histologisch
unter Verwendung von Routineverfahren bewertet. Die Röntgenbilder
wurden benützt,
um die Heilung zu bewerten.
-
Zwölf Wochen
nach der Operation wurde jedes Tier durch intravenöse Barbituratüberdosis
getötet.
Sowohl rechte als auch linke distale Oberschenkel wurden im Ganzen
entfernt und in kalter Salzlösung
bis zur groben Einteilung beibehalten und die Mikrophotographie
wurden abgeschlossen. Die Proben wurden dann in 4% Paraformaldehyd-Fixierung
platziert, mit allen nötigen
Identifizierungen beschriftet und bei 4°C bis zum Versand ungefähr 10 Tage
nach der Tötung
gelagert. Erst vor dem Versand wurden die Proben mit dem artikulären Defekt
in der Mitte, in kleine Blöcke
zugeschnitten.
-
Grobe Analyse
-
Jeder
entnommene Defekt wurde hinsichtlich seines groben Erscheinungsbildes
eingeteilt. Diese Analyse-Zuteilungspunkte basierten auf der Bildung
von intra-artikulären
Adhäsionen,
Wiederherstellung der artikulären
Oberfläche,
Erosion und Aussehen des Knorpels. Insgesamt waren 8 Punkte möglich. Die
grobe Einteilungsskala wird in Tabelle 13 dargelegt.
-
Tabelle
13: Grobe Einteilungsskala
-
Histologie
-
Alle
Proben wurden für
die histologische Bewertung präpariert.
Die einzelnen Proben wurden durch Eintauchen in 4% Paraformaldehydlösung fixiert.
Außerdem
wurden, wie hierin anderswo beschrieben, unter Verwendung von Routineverfahren
Gewebetypisierungsanalysen durchgeführt, um die Kollagenart und
die Prozent an Gewebezusammensetzung zu charakterisieren. Nicht
entkalkte Schnitte, einer von jeder Probe, gefärbt mit Safranin O und Fastgrün-Farbstoffen
(um den Glycosaminoglycangehalt in der Matrix anzuzeigen), wurden
für die
Bewertung zurückbehalten.
-
Histologische
Schnitte basierten auf der Natur des reparierten Knorpels, den strukturellen
Eigenschaften und zellulären
Veränderungen.
Die histologische Einteilungsskala wird in Tabelle 14 dargelegt.
-
-
ERGEBNISSE
-
Alle
Operationen verliefen ohne postoperative Komplikationen. Im Allgemeinen
wurde in allen vier Tieren etwas Schwellung am medialen Knie am vierten
Tag nach der Operation bilateral beobachtet und sie hatte sich am
Tag 10 nach der Operation widergelegt. Kein Tier erlebte irgendwelche
nachteiligen Reaktionen bezüglich
des implantieren Materials oder der Untersuchungsvorgänge.
-
Grobe Bewertung
-
Eine
Zusammenfassung der durchschnittlichen, groben Bewertungsgrade scheint
in Tabelle 15 auf.
-
Tabelle
15: Durchschnittliche, grobe Bewertungsgrade ± Standardabweichung(en)
-
Histologische Bewertung
-
Die
nicht behandelten Defekte und mit verbesserter osteogener Vorrichtung
von OP-1, Kollagenmatrix und CMC behandelten Defekte erhielten die
höchsten,
durchschnittlichen, histologischen Grade 15 bzw. 16,5 von 24 möglichen
Punkten. In jeder dieser Gruppen schaute jedoch eine Probe merklich
besser aus als die anderen. Die mit Kollagenmatrix alleine, mit
Kollagenmatrix mit CMC und mit osteogener Standardvorrichtung alleine
behandelten Stellen ergaben jedoch etwas gleichbleibendere und niedrigere
Bewertungen als die Stellen, welche mit verbesserter osteogener
Vorrichtung (n ≤ 2)
behandelt wurden. Eine Zusammenfassung der durchschnittlichen histologischen
Grade scheint in Tabelle 16 auf.
-
Tabelle
16: Durchschnittlicher histologischer Bewertungsgrad ± Standardabweichung
-
Unerwartet
erzielten die mit verbesserter osteogener Vorrichtung behandelten
Stellen die höchste durchschnittliche
Punktezahl für
die Art des neuen, reparierten Gewebes, für die strukturellen Eigenschaften der
Reparatur und für
die Minimierung der Degeneration des reparierten Knorpels oder des
umgebenden, intakten Knorpels. Die verbesserten osteogenen Vorrichtungen
erhielten auch die höchsten
Gesamtpunkte. Diese Ergebnisse wurden durch die Punktezahl von einem
Tier gewichtet, in welchem die zelluläre und Gewebemorphologie mit
dem Gelenkknorpel übereinstimmte.
Der reparierte Knorpel war durchgehend mit intaktem Knorpel und
die Dicke der Reparatur war gleich wie im intakten Knorpel. Die
subchondrale Knochenschicht war auch ganz wiederhergestellt. Die
Heilung war in den anderen Stellen, die mit der OP-1/Kollagenmatrix
mit oder ohne CMC behandelt waren, nicht so weit fortgeschritten.
Niedrige Punkte waren das Ergebnis von unvollständiger Differenzierung im reparierten
Gewebe, unvollständigem
Wiederaufbau von subchondralem Knochen und ungleichmäßiger Dicke
der Reparatur. Verbleibendes Implantat oder Trägermaterial wurde in keinem Schnitt
beobachtet.
-
Ein
Vergleich unter den Tieren zeigte, dass in drei Tieren die Defekte,
welche Vorrichtungen erhielten, die OP-1 mit oder ohne CMC (alle
linken Defekte) enthielten, histologische Grade erzielten, die gleich
oder größer waren
als die kontralateralen Defekte, welche die Kontrollmatrix, oder
keine Behandlung erhielten.
-
Unerwartet
induzierte die OP-1-Vorrichtung ohne CMC Knochen- und Knorpelbildung,
aber in einer disorganisierteren Weise, wobei erhebliches, fasriges
Gewebe vorhanden war. Unbehandelte Probe oder Proben mit Träger alleine
waren durch fasrigen Knorpel und dichtes Bindegewebe gefüllt.
-
Diese
Daten deuten darauf hin, dass die mit der verbesserten osteogenen
Vorrichtung erzielte, unerwartet verbesserte Reparatur mit den Unterschieden
in ihrer Konsistenz hinsichtlich der osteogenen Standardvorrichtung
ohne Bindemittel in Zusammenhang steht, was wiederum die Eingrenzung
der Vorrichtung an der Defektstelle selbst beeinflusst. Es wird
erwartet, dass Adhäsion
der Formulierung und Disintegrationseigenschaften in artikulären Knochendefekten
aufgrund der dynamischen Natur des Gelenks entscheidend sind.
-
Immunfärbung von Typ I- und Typ II-Kollagen
und Mikroskopie mit polarisiertem Licht
-
Diese
Untersuchung färbte
auch Schnitte, um Kollagenreparatur an den Defektstellen zu vergleichen, die
behandelt waren mit: keiner Vorrichtung, zwei Arten von nur Matrix-Zusammensetzungen
(Matrix und Matrix/Bindemittel) oder beide Matrixzusammensetzungen
mit OP-1.
-
Im
Allgemeinen wurde unter der Verwendung von Kollagen Typ I-Antikörper die
Färbung
des bestehenden, darunterliegenden subchondralen Knochens sowie
des neu gebildeten Knochens beobachtet. Der neu gebildete Knochen
unterschied sich, wenn er unter dem Phasenkontrastmikroskop betrachtet
wurde, durch die Anwesenheit von Bereichen an unorganisierterer
Matrix leicht vom bestehenden Knochen. Unter Verwendung von Typ
II-Kollagenantikörper
färbten
sich der bestehende Gelenkknorpel qualitativ sowie das Reparaturgewebe
in den Defekten, obwohl die Färbung
von neuem Gewebe weniger intensiv war. In mindestens einem Defekt,
der mit verbesserter osteogener Vorrichtung behandelt wurde, wurde
vollständige
Regeneration des subchondralen Knochens beobachtet, wobei sich artikulär-ähnlicher
Knorpel entlang der Oberfläche regenerierte.
Die zelluläre
Matrix von diesem regenerierten Knorpel war nicht identisch zum
bestehenden Gelenkknorpel, aber eine sichtbare zelluläre Matrix,
zusammengesetzt aus großen,
lockeren Bündeln,
konnte unter den Phasenkontrast beobachtet werden.
-
Defekte,
behandelt mit verbesserter osteogener Vorrichtung. In Defekten,
die mit verbesserter osteogener Vorrichtung behandelt wurden, zeigte
mindestens ein Tier auf makroskopischem Niveau Reparatur des Gelenkknorpels.
Der subchondrale Knochen wurde regeneriert und eine neue Knorpelschicht
von nahezu normaler Dicke wurde durch histologische Färbung mit
Toluidenblau und Safranin O beobachtet. Diese Schichten und Gewebe
färbten
sich entsprechend, wobei Typ I-Antikörper im
subchondralen Knochen lokalisiert war und Typ II-Kollagen in der
neuen Knorpel-ähnlichen
Schicht vorhanden war. Es gab auch manche Anzeichen für die Regeneration
einer Zone an verkalktem Knorpel und eine eindeutige Oberbegrenzung
(„tide
mark") in dem regenerierten
Knorpel.
-
Manche
Unterschiede wurden jedoch zwischen der neuen und bestehenden Gelenkknorpelschicht
beobachtet. Der neue Knorpel wies eine höhere Dichte an Chondrocyten
auf und enthielt lockere, unorganisierte Faserbündel, die durch Phasenkontrastmikroskopie
oder mit polarisiertem Licht sichtbar waren. Es sollte beachtet
werden, dass nur einzelne Zeitpunkte während des Reparaturprozesses
hier repräsentiert
sind und dass die Ergebnisse von längeren oder kürzeren Perioden
nicht bekannt sind.
-
Defekte,
behandelt mit osteogener Standardvorrichtung. Die mit osteogener
Standard-Vorrichtung behandelten Defekte zeigten, dass ungefähr 50% des
Knochens in der defekten Stelle mit einwachsendem Gelenkknorpel
von den Rändern
des Defekts regeneriert wurden. Es schien neben dem neu regenerierten Knochen
noch einige zusätzliche
Gebiete mit Gelenkknorpelbildung zu geben, wobei der Rest des Defekts
mit reparativem Gewebe gefüllt
war. Das Reparaturgewebe färbte
sich leicht mit Kollagen Typ II- und nicht mit Typ I-Kollagen-Antikörpern. Es
waren mehr Chondrocyten vorhanden, wobei große Bündeln an Matrix die Zellen umgaben.
Die Behandlung mit der osteogenen Standard-Vorrichtung unterschied
sich von der Behandlung der verbesserten osteogenen Vorrichtung,
indem der subchondrale Knochen sich nicht zu seinem normalen Niveau
regenerierte und dichtes unorganisiertes Fasergewebe oberhalb des
neuen Knorpels erschien, welches verursachte, dass der Oberteil
des Defekts sich mit einer unregelmäßigen Oberfläche ausbeulte.
Dieses fasrige Gewebe schien mehr Fibroblasten-ähnliche Zellen mit Faserbündel aufzuweisen,
die parallel zu der artikulären
Oberfläche
lagen.
-
Defekte,
behandelt mit Matrix/Bindemittel. Ein Defekt mit nur Matrix/Bindemittel
ohne OP-1 zeigte Regeneration von etwa einem Drittel des entfernten
subchondralen Knochens, wobei der Rest durch Reparaturgewebe gefüllt war.
Dieses regenerierte Gewebe färbte
sich mit Typ I-Kollagen-Antikörpern
leicht, insbesondere nahe dem Boden des Defekts, und zeigte stärkere Färbung mit
Typ II-Kollagen-Antikörper, mit
stärkerer Färbung nahe
der Oberfläche.
Eine dichte, unorganisierte, sichtbare Matrix ist in der oberen
Hälfte
des Reparaturgewebes offensichtlich und ein organisierteres, horizontales
Muster an Fasern erscheint in der unteren Hälfte. Toluidinblau färbte das
Reparaturgewebe nicht, wohingegen Safranin O die obere und unter
Hälfte
differentiell färbte.
Die Hälfte
neben der artikulären
Oberfläche
färbte
sich mit Safranin O leicht und die untere Hälfte färbte mit Fast-Green. Eine ähnliche
Unterscheidung wurde zwischen den beiden Hälften des Reparaturgewebes
beobachtet, wenn es mit Masson-Trichrom gefärbt wurde. Obwohl das Reparaturgewebe
nicht wie Gelenkknorpel aussah, schien der Bereich nahe der artikulären Oberfläche kein
Typ II-Kollagen zu enthalten, eine saure Matrix mit möglicherweise
einigen Mucopolysacchariden. Die untere Hälfte hatte mehr Typ I-Kollagen
mit weniger Kohlenhydrat und ist vielleicht in der Art ähnlicher
wie Bindegewebe.
-
Der
nur mit Kollagenmatrix behandelte Einzeldefekt zeigte keine Regeneration
des subchondralen Knochens. Das Reparaturgewebe, welches den Defekt
ausfüllte, färbte sich
sowohl mit Kollagen Typ I- und II-Antikörpern leicht. Dieses Gewebe
hatte eine vermehrte fasrige Matrix mit Fibroblasten-ähnlichen
Zellen und schien in manchen Gebieten ähnlich wie Faserknorpel zu
sein. Diese Probe war ähnlich
zu der Behandlung mit der CMC/Kollagenmatrix alleine, wobei sowohl
Typ I- als auch II-Kollagen
in dem Reparaturgewebe vorkamen. Außerdem zeigte die Defektstelle
die gleiche differentielle Färbung
wie Safranin O/Fast-Green, mit Färbung
an der oberen Hälfte
des Reparaturgewebes mit Safranin O und am unteren Ende mit Fast-Green.
-
Zusammenfassung und Schlussfolgung
-
Osteochondrale
Defekte, die mit verbesserten osteogenen Vorrichtungen behandelt
wurden, zeigten unerwartet eine fortgeschrittenere Knorpelregeneration,
einen Chondrocyten- und Knorpelphänotyp, verglichen mit Defekten,
die mit osteogener Standardvorrichtung, Kollagenmatrix alleine oder
Kollagenmatrix gemischt mit CMC behandelt wurden, von welchen alle
weniger organisierten, reparierten Knorpel und geringere subchondrale
Knochenbildung aufwiesen. Schwache Reparatur durch Behandlung mit
der Kollagenmatrix oder Kollagenmatrix mit CMC deutet darauf hin,
dass die Anwesenheit eines Kollagengerüsts alleine nicht ausreichend
ist, um Heilung zu induzieren, und den Heilungsfortschritt und die
Organisation von Reparaturgewebe tatsächlich behindern kann.
-
Osteochondrale
Defekte über
die gesamte Dicke können
unter Verwendung von CMC-enthaltenen osteogenen Vorrichtungen in Übereinstimmung
mit den Verfahren der vorliegenden Erfindung repariert werden. Es
wird erwartet, dass osteochondrale Defekte über die gesamte Dicke unter
Verwendung von verbesserten osteogenen Vorrichtungen repariert werden
können,
welche irgendeines der vorstehend erwähnten bevorzugten Bindemittel
wie zum Beispiel Fibrinkleber und/oder irgendeine der vorstehend
erwähnten,
bevorzugten Matrizen enthalten.
-
2. Experiment 2: Langzeit-Bewertung
von Reparatur von osteochondralen Defekten über die gesamte Dicke (Hunde)
-
Diese
Studie wurde durchgeführt,
um die Reparatur von osteochondralen/chondralen Defekten durch verbesserte
osteogene Vorrichtungen weiter zu bewerten. Bis jetzt hat die Studie
die Effekte der verbesserten osteogenen Vorrichtung bei 6 und 12
Wochen untersucht und wird die Effekte bis 26 und 52 Wochen weiter untersuchen.
Sie stellt Langzeit-Reparaturstabilitätsdaten bereit. Die Organisation
von neuem Knorpel über
die Zeit wurde beobachtet, um zu bestimmen, ob er im Hinblick auf
seine Struktur und Funktion annähernd
gleich zu normalem Gewebe ist. Zwei Formulierungen von Vorrichtungen
wurden in osteochondralen/chondralen Defekten bewertet, einschließlich: 1)
verbesserte osteogene Vorrichtung, oder 2) Scheinvorrichtungen,
die nur CMC und Kollagenmatrix enthielten.
-
Kurz
gesagt wurden auf dem medialen Oberschenkelcondylus von 16 ausgewachsenen
Mischlingshunden bilateral 5-mm-Defekte im Durchmesser über die
gesamte Dicke erzeugt, die sich 6 mm in den subchondralen Knochen
ausdehnten. Die ausgewachsenen Mischlingshunde wurden in dieser
Studie aufgrund ihrer anatomischen Größe und bekannten Knochenreparatur-
und Umformungseigenschaften verwendet. Alle Tiere waren zwischen
1 und 4 Jahre alt und wogen ungefähr 20 bis 30 Kg. Besondere
Aufmerksamkeit wurde der Auswahl von Tieren von einheitlicher Größe und einheitlichem
Gewicht gezollt, um die Variabilität in der Gelenkbelastung zu
limitieren. Die Tiere wurden röntgenografisch
durchmustert, um die richtige Größe und Skelettreife
zu garantieren und dass keine offensichtlichen ossalen Abnormalitäten existierten.
In jeder Gruppe von vier Hunden erhielten die Defekte der linken
Seite verbesserte osteogene Vorrichtung. Die Defekte der rechten
Seite erhielten in zwei Tieren Matrix/Bindemittel und die verbleibenden
zwei Tiere wurden nicht behandelt. Bei der Tötung wurden die distalen Oberschenkelknochen
im Ganzen entnommen und die Defektstellen histologisch und grob
auf der Grundlage des vorstehend beschriebenen Schemas beurteilt.
-
Die
verbesserte osteogene Vorrichtung umfasst Standardvorrichtung (2,5
mg rhOP-1/1 g Matrix) gemischt mit CMC. Um die verbesserte Vorrichtung
zu formulieren, wurden unmittelbar vor der Implantation (gesamt
120 mg) 100 mg des rhOP-1/Kollagengemisches mit 20 mg CMC gemischt.
Die Vorrichtung nur aus Kollagen besteht aus Typ I-Rinderkollagen
(100 mg). Dieser Studienaufbau wird in Tabelle 17 zusammengefasst.
-
Tabelle
17: Osteochondrale Defektreparatur in Hunden
-
Operation
-
Unter
Verwendung von aseptischen Techniken wurde die Operation unter Isofluorangas-Anästhesie durchgeführt. Ein
medialer parpatellarer Einschnitt von ungefähr vier Zentimetern Länge wurde
gemacht. Die Patella wurde lateral zurückgezogen, um den Oberschenkelcondylus
freizulegen. Unter Verwendung einer Bohrspitze von 1/8 Zoll wurde
ein Pilotloch in die gewichtstragende Region des medialen Oberschenkelcondylus
gemacht. Eine 5-mm-Bohrspitze mit besonders entworfener Manschette,
um die zu tiefe Bohrung der Defekttiefe (6 mm) zu verhindern, wurde
verwendet, um den endgültigen
Defekt zu erzeugen. Nach ausgiebigem Spülen Salzlösung, um die Knochentrümmer sowie
ausgelaufenen Knochenmarkzellen zu entfernt, wurde die entsprechende
experimentelle Vorrichtung wurde unter Verwendung einer stumpfen
Sonde in die Defektstelle gepackt. Die Gelenkskapsel und Weichgewebe
wurden dann sorgfältig
in Schichten geschlossen. Das Verfahren wurde auf der kontralateralen
Seite mit dem entsprechenden Implantat wiederholt.
-
Bewertung
-
Jeweils
vier Tiere wurden 6 und 12 Wochen und vier Tiere 26 und 53 Wochen
nach der Operation getötet.
Die Tiere wurden unter Verwendung einer intravenösen Barbituratüberdosis
getötet.
Die Oberschenkelknochen wurden sofort im Ganzen entfernt und in
einer mit Salzlösung
getränkten
Windel gelagert. Hoch auflösende Photographien
der Defektstellen wurden gemacht. Weichgewebe wurde sorgfältig von
der Defektstelle weg präpariert.
Das proximale Ende des Oberschenkelknochens wurde entfernt.
-
Das
grobe Erscheinungsbild der Defektstellen und des reparierten Gewebes
wurden basierend auf den vorstehend beschriebenen Parametern durch
zwei unabhängige
Beobachter eingeteilt, welche die Behandlungsanweisung nicht kannten.
Punkte wurden gemäß dem Vorhandensein
von intra-artikulärer
Adhäsion,
Wiederherstellung der artikulären
Oberfläche,
Knorpelerosion und Erscheinung zugeteilt.
-
Alle
Proben wurden für
histologische Beurteilung sofort nach der groben Einteilung und
Photographie erzeugt. Die einzelnen distalen Oberschenkelknochen
wurden durch Eintauchen in 10% gepufferte Formalinlösung oder
in 4% Paraformaldehydlösung
fixiert. Auf einer wassergekühlten
Diamantensäge
wurde jede Defektstelle isoliert. Drei Schnitte aus drei Ebenen
wurden von jedem Block geschnitten. Ebenen 1 und 3 waren am nächsten zum
defekten Umkreis. Ebene 2 lag im Zentrum des Defekts. Drei Schnitte
aus jeder Ebene wurden entweder mit Hämatoxylin und Eosin, Goldner-Trichrom,
Safranin O oder Fast-Green gefärbt.
Die Schnitte wurden dann basierend auf dem vorstehend beschriebenen
Schema eingeteilt. Diese Analyse vergab Punkte basierend auf der
Art des reparierten Gewebes, der strukturellen Eigenschaften und
den zellulären
Veränderungen.
Insgesamt waren 24 Punkte möglich.
-
Ergebnisse und Schlussfolgerung
-
Nach
6 Wochen wurden bestimmte der vorstehend behandelten Tiere getötet und
immunhistochemische Bewertungen wurden, wie hierin anderswo beschrieben,
durchgeführt.
Die Ergebnisse waren wie folgt: in allen Fällen zeigten die mit OP-1-CMC/Kollagenvorrichtung
behandelten Defekte eine überragende
Reparatur. Mit der OP-1-CMC/Kollagenvorrichtung gab es unerwartet
vollständige
oder fast vollständige Überbrückung der
Defekte mit Knorpelgewebe. Typ II-Kollagenfärbung wurde im reparativen
Knorpel mit wenig oder keiner Typ I-Kollagenfärbung beobachtet. Proteoglycanfärbung folgte
der Typ II-Kollagen Lokalisierung mit dunklerer Färbung in
Gebieten, die mehr dem reifen Hyalinknorpel ähnelten. Basierend auf Safranin
O- Färbung war
die Regeneration der Oberflächenschicht
des Knorpels 6 Wochen nach der Behandlung noch nicht komplett.
-
Nach
12 Wochen war die Heilung in den Defekten, die mit verbesserten
Vorrichtungen behandelt waren, erheblich fortgeschritten. In den
Kontrollen wurde keine sichtbare Heilung beobachtet. Die mit verbesserten
Vorrichtungen beobachtete, durchschnittliche, grobe Einteilungsbewertung
nach 12 Wochen war 6,50 ± 0,89
(n = 8); Kontrolldurchschnitt war 3,69 ± 0,70 (n = 8). Bei allen
verbleibenden Zeitpunkten wird erwartet, dass die Defekte, die mit
den verbesserten osteogenen Vorrichtungen behandelt werden, fortgeschrittenere Knorpelregeneration
und Chondrocyten- und Knorpelphänotyp
in einer beschleunigten Weise im Vergleich mit Defekten zeigen werden,
die nur mit Kollagen/CMC behandelt oder unbehandelt belassen wurden.
Von den mit verbesserter osteogener Vorrichtung behandelten Defekten
wird erwartet, dass sie Knorpel- und subchondrales Knochengewebe
zeigen, wohingegen von den mit Kollagen/CMC behandelten oder unbehandelten
Defekten erwartet wird, dass sie unorganisierte Knochen- und Knorpelbildung
mit beträchtlichem
Fasergewebe induzieren.
-
Osteochondrale
Defekte von gesamter Dicke können
unter Verwendung von CMC-enthaltenden osteogenen Vorrichtungen gemäß den Verfahren
der vorliegenden Erfindung stabil repariert werden. Es wird erwartet,
dass Experimente, die ähnlich
jenen vorstehend beschriebenen sind, in welchen andere bevorzugte Bindemittel
wie zum Beispiel Fibrinkleber bewertet werden, zeigen werden, dass
verbesserte osteogene Vorrichtungen osteochondrale Defekte von gesamter
Dicke stabil reparieren können.
-
E. Reparatur von chondralen
Defekten unter Verwendung von verbesserten osteogenen Vorrichtungen,
die Carboxymethylcellulose enthalten
-
1. Experiment 1: Langzeit-Bewertung
der Reparatur von chondralen im Vergleich zu osteochondralen Defekten (Schaf)
-
Diese
Studie bewertet die Reparatur von sowohl chondralen als auch osteochondralen
Defekten durch verbesserte osteogene Vorrichtungen unter Verwendung
eines Modells mit großen
Tieren. Die erhöhte
Dicke des artikulären Knorpels
und die Ähnlichkeit
zum Menschen in Größe und Gewichtstragenden
Eigenschaften machen das Schaf zu einem Modell, von welchem menschliche
klinische Anwendungen extrapoliert werden können, insbesondere für klinische
Anwendung von verbesserte osteogenen Vorrichtungen für die Reparatur von
chondralen Defekten. Die Untersuchungsgruppen sind wie folgt:
-
A-OsteoHchondrale (gesamte
Dicke) Defekte (5 mm Durchmesser);
-
- Gruppe A I: keine Behandlung
- Gruppe A II: Carboxymethylcellulose/Kollagen
- Gruppe A III: Carboxymethylcellulose/OP-1/Kollagen
- Gruppe A IV: lyophilisiertes allogenes Transplantat
- Gruppe A V: lyophilisiertes allogenes Transplantat + OP-1
-
B-Chondrale (teilweise
Dicke) Defekte (5 mm Durchmesser);
-
- Gruppe B I: keine Behandlung
- Gruppe B II: Carboxymethylcellulose/Kollagen
- Gruppe B III: Carboxymethylcellulose/OP-1/Kollagen
- Gruppe B IV: Hyaluronsäure
+ Chondroitinsulfatpaste
- Gruppe B V: Hyaluronsäure
+ Chondroitinsulfatpaste + OP-1
-
Beide
Vorderkniegelenke jedes Schafs werden operiert und es werden zwei
Defekte pro Gelenk erzeugt (jeweils einer auf dem medialen und dem
lateralen Condylus). Eines der Gelenke hat zwei standardisierte
chondrale Defekte von teilweiser Dicke (5 mm im Durchmesser), erzeugt
auf jedem Condylus, während
das andere Gelenk zwei tiefere osteochondrale Defekte mit voller
Dicke (etwa 1-2 mm in den subchondralen Knochen) hat. Jede Gruppe
hat eine Untergruppe, die früh
bei 8 Wochen getötet
wurde, und eine andere, die für Langzeitbewertungen
für 6-7
Monate behalten wird.
-
Es
gibt insgesamt 20 Gruppen und 12 Defekte pro Gruppe. Die Gesamtzahl
der Defekte ist daher 240 und die Gesamtzahl der Schafe ist 60.
Es gibt fünf
verschiedene Behandlungsgruppen; drei Kontrollen (keine Behandlung
und zwei unterschiedliche Scheinvorrichtungen) und zwei unterschiedliche
OP-1- Formulierungen für jeden
Defekttyp. Verbesserte osteogene Vorrichtungen, die OP-1 in CMC/Kollagen
umfassen, werden für osteochondrale
Defektreparatur und chondrale Defektreparatur verwendet werden.
Die Vorrichtungen werden so zusammengestellt, dass 2,5 mg OP-1/g
Kollagen zu jeder Defektstelle hinzugefügt werden, welche diese verbesserte
osteogene Vorrichtung erhält.
Die Reparatur wird bei 8 Wochen und 6-7 Monaten bewertet. Das Behandlungsprotokoll
wird in Tabelle 18 gezeigt.
-
Tabelle
18: Reparatur von chondralen und osteochondrale Defekten im Schaf
unter Verwendung von OP-1
-
Die
Operationen an den beiden Knien werden über zwei Wochen gestaffelt,
um die Heilung des ersten Knies vor der Operation am zweiten Knie
zu ermöglichen.
Die erste Operation wird verwendet, um chondrale Defekte zu erzeugen,
die zweite ist für
osteochondrale Defekte. Die Operation wird in einem vollständig ausgerüsteten Operationssaal
unter Verwendung von Standardtechniken und -Geräten durchgeführt, die
bei der Chirurgie am Menschen verwendet werden. Es wird den Schafen
ermöglicht,
nach der Operation frei auf ihrem Weidegebiet zu wandern. Die gestaffelten
Operationen resultieren in 8-Wochen-Heilungszeiten für chondrale Defekte
und 6-Wochen-Heilungszeit für
osteochondrale Defekte. Bei der Tötung werden die Gelenke durchspült, fixiert
und gemäß cytologischen
Standard-Protokollen
verarbeitet.
-
Am
Ende der Untersuchungsperioden werden die Tiere getötet und
die Gelenke im Ganzen entnommen. Das grobe Erscheinungsbild der
Defektstelle und des reparierten Gewebes wird unter Verwendung von Routineverfahren,
wie jenen, die vorstehend beschrieben wurden, eingeteilt. Punkte
werden gemäß der Anwesenheit
von intra-artikulären
Adhäsionen,
Wiederherstellung der artikulären
Oberfläche,
Knorpelerosion und dem Aussehen vergeben.
-
Unter
Verwendung von Verfahren, die jenen vorstehend beschriebenen ähnlich sind,
werden Proben für
histologische Beurteilung sofort nach der groben Einteilung und
Photographie erzeugt.
-
Es
wird erwartet, dass Defekte, die mit OP-1/CMC/Kollagenvorrichtungen
behandelt wurden, eine bessere Reparatur zeigen werden, ähnlich zu
jener vorstehend in Experiment D. 2 erwähnten. Es wird ferner erwartet,
dass verbessere osteogene Vorrichtungen, welche irgendwelche der
vorstehend erwähnten,
bevorzugten Bindemittel enthalten, wie zum Beispiel Fibrinkleber,
auch die Reparatur von sowohl chondralen als auch osteochondralen
Defekten zeigen werden.
-
2. Experiment 2: Langzeitbewertung
von Reparatur unter Verwendung von unterschiedlichen Dosierungen
an OP-1 in subchondralen Defekten (Ziegen)
-
Eine
Untersuchung unter Verwendung von Milchziegen mit reifem Skelett
wird durchgeführt,
um die Wirksamkeit von verbesserter osteogener Vorrichtung zur Reparatur
von osteochondralen/chondralen Defekten zu zeigen. Formulierungen
von verbesserter osteogener Vorrichtung mit unterschiedlichen Konzentrationen
an rhOP-1 werden
gemeinsam mit Scheinkontrollen oder Kontrollen ohne Vorrichtung
verwendet. Die Scheinvorrichtungen bestanden aus Kollagen, gemischt
mit Carboxymethylcellulose (CMC). Darüber hinaus werden die Tiergruppen
bei 4, 12 und 24 Monaten nach der Operation getötet, um die Rate und Stabilität der Defektreparatur
zu vergleichen. Das Folgende fasst die experimentellen Parameter
zusammen: Gruppen
-
Kurz
gesagt werden subchondrale Defekte in den linken Knien von 56 Milchziegen
erzeugt, die ein voll entwickeltes Skelett aufwiesen: Die Defekte
sind 8 mm im Durchmesser und 3 mm tief. Diese Defektkonfiguration
verhindert sehr hohe Scherbeanspruchung im Defekt, was zur Bildung
von Typ I-Kollagen führt.
Holländische
Milchziegen, die etwa 2 Jahre alt sind und ungefähr 50 kg wiegen, worden in
diesem Experiment verwendet. Vorrichtungen, die 2,5 mg rhOP-1/Gramm
Kollagen entsprechen, werden bereitgestellt. In jedem Fall werden
0,2 Gramm CMC zu der osteogenen Standardvorrichtung hinzugefügt, dann
werden ungefähr
2,6 ml Salzlösung
hinzugefügt
und gemischt. Das ergibt Material von ungefähr 3—4 ml an verbesserter osteogener Vorrichtung.
Dieses Material wird dann verwendet, um das Defektvolumen zu füllen.
-
Operationstechnik
-
Anästhesie
wird induziert und das linke Knie wird mittels eines medialen parapatellaren
Ansatzes geöffnet.
Die Patella wird auf die laterale Seite disloziert und der mediale
Condylus wird freigelegt. Mit einer scharfen hohlen Röhre werden
die Umrisse eines Defekts im vorderen, Gewichts-tragenen Teil des
medialen Condylus gemacht. Mit einem quadratisch zugespitzten Handbohrer,
der in die Röhre
platziert wird, wird ein Defekt bis in den subchondralen Knochen
erzeugt. Die proximale Tibia wird dann exponiert und ein periostaler Lappen
vom gleichen Durchmessser wie der Defekt in dem medialen Condylus
wird entnommen. Der periostale Lappen wird teilweise fixiert, mit
seiner Cambiumschicht in Richtung des Defekts, zu den Überresten.
Der Defekt wird mit dem entsprechenden Testmaterial gefüllt und
unter Verwendung einer resorbierbaren Naht mit dem periostalen Lappen
bedeckt. Die CMC-Vorrichtung wird über eine Nadel hinzugefügt, bis
der Defekt gefüllt ist,
und dann wird der Lappen vollständig
angenäht.
In Kontrolltieren wird eine Scheinvorrichtung einschließlich nur
Kollagen und CMC verwendet. Eine zweite Kontrollgruppe erhielt gar
kein Implantat, erhielt aber einen periostalen Lappen.
-
Postoperative Behandlung
-
Uneingeschränkte, Gewichts-tragende
Aktivität
wird, soviel nach der Operation toleriert werden kann, erlaubt.
-
Klinische Durchführung
-
Das
Muster der Gewichtsbelastung wurde bei 2, 4, 6 und 8 Wochen und
danach alle 4 Wochen bestimmt.
-
Grobe Analyse
-
Grobe
Bewertungen werden basierend auf dem vorstehend gezeigten Schema
gemacht. Nach der Tötung
des Tieres wird die Anwesenheit oder Abwesenheit der Kniekontrakturen
protokolliert und sowohl Patella als auch Condylen des Oberschenkelknochens
werden auf Adhäsion,
artikuläre
Oberflächenkontur,
Aussehen des wiederhergestellten Knorpels und Anwesenheit oder Abwesenheit
von Knorpelerosionen bewertet. Jeder dieser Eigenschaften wird ehe
Bewertung verliehen. Farbaufnahmen werden unter Verwendung eines
Makroobjektivs gemacht.
-
Histologische Analyse
-
Um
die Sichtbarmachung des regenerierten subchondralen Knochens zu
unterstützen
und die Grenzen des Defekts während
der histologischen Bewertung zu lokalisieren, erhalten die Ziegen
vor der Tötung
ein doppelt markiertes Tetracyclin. Das ermöglicht die Histomorphometrie
der Knochenfüllung
des tieferen Teils des Defekts. Die histologischen Proben werden
auch durch Einbau von polarisierter Mikroskopie betrachtet, um Information über reguläre strukturelle
Merkmale bereitzustellen.
-
Zur
histologischen Analyse werden die Proben, einschließlich des
subchonralen Knochens, in 10% Phosphat-gepuffertem Formalin fixiert
und werden nicht entkalkt in Methylmethacrylat (MMA) eingebettet.
Mit einem Hochleistungsmikrotom werden 5 μm dicke Schnitte gemacht. Die
Schnitte werden mit Toluidinblau gefärbt, um Knorpel zu identifizieren,
und mit Goldner-Trichrom, um Knochen zu identifizieren. Gewebe-Hyalinität, Affinität der Matrix
für Toluidenblau
(Metachromasil), Oberflächen-Irregularität, durch
Chondrocyten-Klusterbildung wiederhergestellter subchondraler Knochen,
Bindung an den benachbarten Gelenkknorpel, entzündliche Zellinfiltration um
das Implantat, und Freiheit von degenerativen Veränderungen
im benachbarten Knorpel werden bewertet. Jeder dieser Eigenschaften
wird eine Bewertung gegeben.
-
Biochemische Analyse
-
Extraktion
von Proteoglycanen: für
die biochemische Analyse werden Kontrollknorpel und Gewebe vom Defekt
in kalter Phosphat-gepufferter Salzlösung (PUBS) gesammelt. Proteoglycane
werden aus lyophilisierten Schnitten durch Behandlung mit 4 M Guanindin-HCl,
0,15 M Kaliumacetat bei pH-Wert 5,8 in der Anwesenheit von Proteinase-Inhibitoren
(5 mM Benzamindin, 0,1 M 6-Amino-n-hexansäure, 10 mM EDTA, 5 mM Phenylmethylsulfonylfluorid
und 5 mM n-Ethylmaleimid)
bei 4°C
für 60
Stunden extrahiert. Der Extrakt und der Rückstand worden getrennt. Der
Rückstand
wird mit Extraktionspuffer gründlich
gespült,
welcher zum Extrakt hinzugefügt
wird. Die Extrakte werden auf Gehalt an Chondroitinsulfat analysiert
und für
die Gelextraktion verwendet.
-
Gelfiltration:
Aliquote der Extrakte werden auf Sepharose C 12 B-Säulen (0,66 × 145 cm)
(Pharmacia AB, Uppsala, Schweden) aufgetragen und mit einem Dissoziationspuffer
bei pH-Wert 6,1 eluiert, der 4 M Guanidin-HCl, 0,1 Natriumsulfat,
0,05 M Natriumacetat und 0,1% Triton X-100 enthält. Die Durchflussrate ist
1,2 ml/Std. Die Fraktionen werden auf Gehalt an Chondroitinsulfat
untersucht. Die Menge an großen,
Knorpel-spezifischen Molekülen,
wahrscheinlich Aggrecanen, kann berechnet werden.
-
MRI
-
Magnetische
Resonanzabbildung (MRI) wird für
zwei Zwecke durchgeführt.
Erstens, um einen Monat nach der Operation zu überwachen, dass der Lappen
und das Implantat am Platz geblieben sind. Zweitens, Gruppe 1 C
(2 Jahre oder mehr nach der Operation) wird bei 4 Monaten, 12 Monaten
und bei der Tötung
durch MRI longitudinal beobachtet.
-
Zusammenfassung
-
Es
wird erwartet, dass die Defekte, welche mit verbesserter osteogener
Vorrichtung behandelt wurden, fortgeschrittene Knorpelwiederherstellung,
Chondocyten- und Knorpelphänotyp,
verglichen mit der Scheinkontrolle oder den Kontrollen ohne Vorrichtung,
zeigen werden. Es wird auch erwartet, dass niedrige Dosierungen von
OP-1 mindestens Reparatur erzielen werden, die quantitativ und qualitativ ähnlich jenen
mit den höheren Dosierungen
sind.
-
F. Reparatur von chondralen
Defekten unter Verwendung des osteogenen Proteins
-
In
dieser Untersuchung wurde die Säuger-Knorpelbildung
in subchondralen Läsionen
untersucht, die mit rekombinantem menschlichem osteogenem Protein-1
(rhOP-1) (alleine oder in Kombination mit einer Kollagenmatrix)
und/oder autologen Perichondrium behandelt wurden.
-
Material und Verfahren
-
Im
medialen Oberschenkelcondylus des linken Kniegelenks von 15 Ziegen
wurde ein subchonraler Defekt von 9 mm Durchmesser erzeugt. Der
Defekt wurde mit einem Implantat gefüllt, bestehend aus frisch koaguliertem
Blut, gemischt mit: (a) keinen Partikeln von autologen Ohr-Perichondrium;
oder (b) rhOP-1; oder (c) rhOP-1 mit Ohr-Perichondrium. Rh-OP-1
wurde entweder in Kombination mit einer Kollagenmatrix (OP-1-Vorrichtung)
oder ohne eine Kollagenmatrix (OP-1 alleine) hinzugefügt. Der
Defekt wurde mit einem periostalen Lappen geschlossen, welcher an
den Knorpel genäht
wurde. Nach Implantationszeiten von 1, 2 und 4 Monaten wurde das
Reparaturausmaß von
jedem Defekt mit histologischen Standard-Techniken (Metachromasie und Hyalinität) und gut
bekannten biochemischen Verfahren (Gelchromatographie von Proteoglycanen) untersucht.
-
Ergebnisse
-
Nach
1 und 2 Monaten in dieser besonderen Studie gab es keine offensichtlichen
Unterschiede zwischen Kontrolle (Implantat (a) vorstehend) und den
verschiedenen mit OP-1 behandelten Defekten. Nach 4 Monaten jedoch
zeigte nur einer von drei Kontrolldefekten nachweisbare Knorpelbildung,
während
alle vier mit OP-1 behandelten Defekte völlig oder teilweise mit Knorpel
gefüllt
wären,
wie durch die in Tabelle 19 dargelegte histologische und biochemische
Analyse angezeigt wird. Tabelle
19
- 1 Der Defekt wurde in homogene Teile geteilt,
die % werden angezeigt.
- 2 Berechnet wie folgt: % × (A
+B), z.B. 0,86 × (0,7
+ 0,0) = 0,60.
-
Tabelle
19 legt die Knorpelbewertung von kondylären Defekten dar, die für 4 Monate
ohne OP-1 (Kontrolle) oder mit OP-1 mit oder ohne Perichondrium
in der Anwesenheit oder Abwesenheit einer Kollagenmatrix behandelt
wurden.
-
Der
biochemischen Bewertung (A) wurde basierend auf Gelchromatographie
ein Wert von 0-5 zugewiesen.
-
Die
histologische Bewertung (B) basiert auf nicht entkalkten, plastischen
Schnitten auf einer Einteilungsskala von 0 bis 6.
-
Schlussfolgerung
-
Die
Ergebnisse dieser Studie bestätigen,
dass OP-1 in Ziegen eine Knorpelfördernde Fähigkeit in großen subchondralen
Defekten aufweist. Das deutet darauf hin, dass OP-1 in der Behandlung
von großen
Läsionen
des Gelenkknorpels eine klinische Relevanz aufweist und für die chondrale
Reparatur von Gewichts-tragenden Skelettdefekten, die durch Trauma
oder Erkrankung in Säugern
hervorgerufen wurden, besonders nützlich ist.
-
In ähnlichen
Studien wird erwartet, dass die anderen verbesserten osteogenen
Vorrichtungen wie zum Beispiel Fibrinkleber enthaltende Vorrichtungen
in der Reparatur von großen
subchondralen Defekten resultieren werden. Darüber hinaus wird eine solche
Reparatur durch die Regeneration von stabilerem, makellosem Gelenkknorpel
begleitet sein. Es wird ferner erwartet, dass die Reparatur eines
subchondralen Defekts, im Vergleich mit nur mit Kollagen vermischtem
OP-1, bei einer beschleunigten Rate mit verminderten Mengen an OP-1
stattfinden wird, wenn es mit Kollagenmatrix und einem Bindemittel
wie zum Beispiel CMC gemischt wird. Darüber hinaus wird eine solche
Reparatur durch die Regeneration von stabilerem, makellosem Gelenkknorpel
begleitet sein.
-
G. Reparatur von segmentalem
Defekt (kritische und nicht kritische Größe) unter Verwendung von verbesserten
osteogenen Vorrichtungen, welche Apatite und/oder Tricalciumphosphate
(TOP) und/oder Kollagematrizen enthalten.
-
Verbesserte
Vorrichtungen, die eine Vielzahl an Matrizen umfassen, oder Mischungen
davon werden bei unterschiedlichen Dosierungen an OP-1 verwendet
werden, um segmentale Ulna-Defekte in Kaninchen und Hunden zu reparieren
(kritische und nicht kritische Größe). Verbesserte Vorrichtungen
werden umfassen: Pyrost®-Matrix (Osten AG, Schweiz),
einen HAp-Block, stammend aus Rinderknochen; 100% HAp-Körnchen (ungefähr 300-400
oder 350-450 μ);
100% TCP (ungefähr
400 μ);
und 50% HAp/50% TCP (ungefähr
400 μ). Andere
Ausführungsformen
werden eine oder mehrer der vorher beschriebenen Matrizen von geeigneter
Porosität
umfassen. Eine besonders bevorzugte Ausführungsform der verbesserten
osteogenen Vorrichtung wird Collapat® Matrix
(Osten AG, Schweiz) enthalten, einen Schwamm von HAp und Kollagen.
Eine andere besonders bevorzugte Ausführungsform umfasst ungefähr 0,6 g
CMC pro HAp-Körnchen
oder pro g Körnchen
von 75%HAp/25% TCP, insbesondere wenn eine Vorrichtung mit Kittkonsistenz
gewünscht
wird. Eine andere bevorzugte Ausführungsform, die vorstehend
beschrieben wird, enthält β-TCP und
Fibrinkleber.
-
Es
wird erwartet, dass verbesserte Vorrichtungen wie jene, die vorstehend
beschrieben wurden, die Reparatur von segmentalen Defekten induzieren
werden und bestimmte bevorzugte Ausführungsformen das auch bei niedrigen
OP-1-Dosierungen
tun werden.
-
H. Knochenbildung unter
Verwendung von Fibrinkleber als ein Bindemittel
-
Vier
subkutane Studien in Ratten wurden zur Bewertung des Effekts der
Fibrinkleber-OP-1-Formulierung auf Knochenbildung fertig gestellt.
Die Menge an Knochenbildung bei 10 μg OP-1 unter Verwendung der drei
unterschiedlichen Quellen an Fibrinkleber war ähnlich, reichend von 25% bis
40% (siehe Tabellen 19A-19F).
Es gab in diesen Studien keine klare Korrelation zwischen Entzündung und
Knochenbildung. Die Ergebnisse deuten darauf hin, dass Ratten unterschiedlich
mit Fibrinkleber aus unterschiedlichen Arten reagierten; zum Beispiel
rief menschlicher Fibrinkleber von Tissucol
® eine
entzündlich
Reaktion von 2 bis 2,7 (siehe Tabelle 19A) hervor, Rinderfibrinkleber
verursachte eine entzündliche
Reaktion von 2 bis 3,5 (siehe Tabellen 19B und 19C) und Ratten-Fibrinkleber
hatte die niedrigste entzündliche
Reaktion von 1 bis 1,3 (siehe Tabelle 19D) auf einer Skala von 0-4. Üblicherweise
wird eine entzündliche
Reaktion von 3-4 als schwer definiert und 1-2 wird als leicht bis
mittel definiert. TABELLE
19A: IN VIVO-Daten von Tissucol
®/OP-1
- 20 μl OP-1 (10 μg oder 20 μg in 5% Lactose)
wurden vor der subkutanen Implantation mit 50 μl Fibrinogen (70-110 mg/ml)
und 50 μl
Thrombinlösung
(500 E/ml) gemischt.
TABELLE
19B: IN VIVO-Daten von Rinderfibrinkleber - 20 μl
OP-1 (10 μg
in 5% Lactose) wurden vor der subkkutanen Implantation mit 50 μl Rinderfibrinogen
(60 mg/ml) und 50 μl
Rinder-Thrombinlösung
(300 E/ml) gemischt.
TABELLE
19C: IN VIVO-Daten von Rinderfibrinkleber - 20 μl
OP-1 (10 μg
in 5% Lactose) wurden vor der subkutanen Implantation mit 50 μl Rinderfibrinogen
(40 mg/ml) und 50 μl
Rinder-Thrombinlösung
(200 E/ml) gemischt.
TABELLE
19D: IN VIVO-Daten von Rattenfibrinkleber - 20 μl
OP-1 (10 μg
in 5% Lactose) wurden vor der subkutanen Implantation mit 50 μl Rinderfibrinogen
(40 mg/ml) und 50 μl
Rinder-Thrombinlösung
(200 E/ml) gemischt.
-
Zwei
andere in vivo-Studien in Ratten wurden zur Bewertung des Effekts
der Vorrichtungen auf die Knochenbildung ausgeführt, die Fibrinkleber und OP-1
enthielten. In der ersten Studie wurden Rinderfibrinogen (50 μl, Sigma
F8630, 10 mg/ml) und Rinder-Thrombin (50 μl/ml, 50 E/ml) genau vor der
subkutanen Implantation mit OP-1-Vorrichtungen gemischt. Die positiven
Kontrollen sind OP-1-Vorrichtungen,
die mit 100 μl Phosphat-gepufferter
Salzlösung
benetzt sind. Die OP-1
Vorrichtungen werden durch Mischen von 10 μg OP-1 in 47,5% Ethanol/0,01%
TFA mit 25 mg Kollagen gemischt und über Nacht lyophilisiert. Die
Ergebnisse werden in Tabelle 19E gezeigt. Es gab keinen wesentlichen
Unterschied in der Knochenbildung zwischen Standard-OP-1-Vorrichtungen
und OP-1-Vorrichtungen, die mit Rinder-Fibrinkleber kombiniert waren. Auch
wurde eine niedrigere Entzündungsreaktion
auf die OP-1-Vorrichtungen/Rinder-Fibrinkleber-Formulierungen beobachtet,
verglichen mit der Kombination von flüssigem OP-1-Rinder-Fibrinkleber
(siehe TABELLE 19B und 19C).
-
TABELLE
19E: IN VIVO-Daten von Rinderfibrinkleber mit OP-1-Vorrichtung
-
In
einer zweiten Studie wurden unterschiedliche Konzentrationen an
Tissucol® mit
der OP-1-Standardvorrichtung kombiniert. Das heißt, eine lyophilisierte OP-1-Vorrichtung (25 mg
Gesamtgewicht, 10 μg
OP-1) wurde mit menschlicher Fibrinogenlösung (50 μl, Fibrinogen 70-110 mg/ml oder
2- oder 4- oder 8-fach in Phosphat-gepufferter Salzlösung verdünnt) und
Thrombinlösung
(50 μl,
500 E/ml oder 2- oder 4- oder 8-fach in Phosphat-gepufferter Salzlösung verdünnt) sofort
vor der Implantation vereinigt. Die positiven Kontrollen sind OP-1-Vorrichtungen,
die mit 100 μl
Phosphat-gepufferter Salzlösung
benetzt sind. Die Ergebnisse werden in TABELLE 19F gezeigt. Es gibt
keinen wesentlichen Unterschied in Knochenbildung zwischen Standard-OP-1-Vorrichtungen
und OP-1-Vorrichtungen, die mit unterschiedlichen Konzentrationen
an Tissucol® kombiniert
sind. Die Konzentration von Fibrinogen hatte auch keinen wesentlichen
Effekt auf die Knochenbildung.
-
TABELLE
19F: IN VIVO-Daten von Tissucol
®/mit
OP-1-Vorrichtungen
-
Zusammenfassend
wird die Handhabungseigenschaft der OP-1-Standardvorrichtungen durch die Verwendung
von z.B. Fibrinkleber verbessert und die Kollagenpartikel bleiben
im Kleber integriert. Die in vivo-Daten deuteten darauf hin, dass
OP-1-Vorrichtungen mit Fibrinkleber die Knochenbildung fördern.
-
I. Defektreparatur unter
Verwendung verbesserter osteogener Vorrichtungen, die Fibrinkleber
als ein Bindemittel enthalten
-
Verbesserte
Vorrichtungen, die Fibrinkleber enthalten und eine Vielzahl an Matrizen
oder Beimischungen davon umfassen werden bei unterschiedlichen OP-1-Dosierungen in im
Fachgebiet anerkannten Tiermodellen zur Reparatur von Knochen, osteochondralen
oder chondralen Defekten verwendet werden. Andere Ausführungsformen
von bevorzugten Vorrichtungen werden umfassen: Fibrinkleber, Kollagen
und OP-1. Andere Ausführungsformen
von bevorzugten Vorrichtungen werden umfassen: Fibrinkleber, β-TCP und
OP-1. Schließlich
wird eine weitere Überprüfung alle
der vorstehend erwähnten
Matrixmaterialien umfassen, die für die Verwendung in der vorliegenden
Erfindung geeignet sind.
-
Es
wird erwartet, dass verbesserte, Fibrinkleber-enthaltende Vorrichtungen
wie jene, die vorstehend beschrieben werden, die Knochenbildung
in Defekten mit kritischer und nicht kritischer Größe, Pseudoarthrose-Frakturen
und Frakturen fördern
und beschleunigen sowie die Reparatur von osteochondralen und chondralen
Defekten fördern
und beschleunigen.
-
J. Reparatur von segmentalem
Defekt vom (kritischer und nicht-kritischer Größe) unter Verwendung einer
verbesserten Vorrichtung die Fibrinkleber enthält
-
Das
Folgende ist eine vergleichende experimentelle Studie der Wirksamkeit
von verbesserten, Fibrinkleber-enthaltenden Vorrichtungen zur Heilung
von segmentalen Defekten (von kritischer und nicht-kritischer Größe).
-
Testsystem
-
Wie
vorstehend beschrieben, wurden in dieser Studie ausgewachsene Mischlingshunde,
die für
diesen Zweck gezüchtet
wurden, benützt.
Spezielle Aufmerksamkeit wurde der Auswahl der Tiere von einheitlicher
Größe und einheitlichem
Gewicht gezollt, um die Variabilität in der Knochengeometrie und- Belastung zu limitieren.
-
Wie
auch vorstehend beschrieben, wurde die Operation unter Verwendung
von aseptischen Standard-Techniken unter Isofluorangas-Anästhesie
durchgeführt.
Beide Vorderextremitäten
wurden präpariert
und auf sterile Weise abgedeckt. Ein lateraler Einschnitt, von ungefähr zwei
Zentimeter Länge
wird durchgeführt und
die Freilegung der Ulna wird unter Verwendung von stumpfer und scharfer
Präparation
erhalten. Es wird entweder ein Defekt von kritischer oder nicht-kritischer
Größe in der
mittleren Ulna unter Verwendung einer oszillierenden Säge erzeugt.
Der Radius wird für
mechanische Stabilität
beibehalten und es wird keine interne oder externe Fixierung verwendet.
Die Stelle wird mit Salzlösung
gespült
und die Weichgewebe werden sorgfältig
in Schichten um den Defekt geschlossen. Die entsprechende Impantatvorrichtung
wird implantiert oder in die Defekt-Stelle injiziert. Der Vorgang
wird dann auf der kontralateralen Seite mit dem entsprechenden Implantat
wiederholt.
-
Den
Tieren werden intramuskulär
für vier
Tage nach der Operation Antibiotika verabreicht und anterior-posterior
Routine-Röntgenbilder
werden sofort nach der Operation gemacht, um ordentliche chirurgische Platzierung
sicherzustellen. Die Tiere werden in 3 × 4-Fuß-Aufwachkäfigen gehalten, bis sie zeigen,
dass sie ihr Gewicht tragen können,
danach werden sie in Auslaufkäfige überführt und
ihnen wird uneingeschränkte
Bewegung gestattet.
-
Röntgenbilder
der Vorderextremitäten
werden wöchentlich
bis zu vier Wochen erhalten, dann unter Verwendung von standardisierten
Belichtungszeiten und- Intensitäten zweimal
wöchentlich
bis 16 Wochen in den überlebenden
Tieren. Röntgenaufnahmen
werden bewertet und mit früheren
Röntgenbildern
verglichen, um die Qualität
und Geschwindigkeit der Defektheilung einzuschätzen. Veränderungen in der röntgenografischen
Erscheinung werden basierend auf der Anwesenheit und Dichte von
neuer Knochenbildung, dem Ausmaß an
Defekt-Überbrückung und
der Inkorporation der Wirtsknochen-Kortexe bewertet.
-
Testmaterialbeschreibung
-
Die
Implantatmaterialien enthalten rekombinantes menschliches osteogenes
Protein-1 (rhOP-1) in einer Acetatpufferformulierung und rhOP-1
entweder in Fibrinkleber und Kollagen oder Fibrinkleber und β-TCP. Die
rhOP-1-Formulierungen werden mit Kontrollen mit nur Träger verglichen.
Die Acetatpuffer-rhOP-1-Formulierungen
bestehen aus 3,5 mg/ml OP-1 in einem Lactose/Acetatpuffer, verabreicht
in einem 100-μl-Volumen. Die
Trägerkontrolle
besteht aus einem 100-μl- Volumen an Lactose/Acetatpuffer.
Testformulierung enthalten rhOP-1/Fibrinkleber-Kollagen oder rhOP-1/Fibrinkleber-β-TCP.
-
Versuchsanordnung
-
Bilaterale
segmentale Ulnadefekte von kritischer oder nicht-kritischer Größe werden
in allen Tieren erzeugt. Eine Gruppe an Tieren erhält eine
Injektion von 0,35 mg rhOP-1/Acetatpuffer-Formulierungen in einem Defekt
und den Acetatpuffer ohne rhOP-1 in den kontralateralen Defekt.
Eine andere Gruppe an Tieren erhielt eine Injektion von rhOP-1/Fibrinkleber-Kollagen
oder rhOP-1/Fibrinkleber-β-TCP-Formulierung in einen
Defekt und Fibrinkleber-β-TCP
oder Kollagen alleine in den kontralateralen Defekt. Die Tiere wurden
bei Zeitpunkten von 4, 8 und 12 Wochen nach der Operation getötet. Bestimmte
Hunde erhalten bilaterale Defekte ohne Implantat (nur Defekte) und
werden bei Zeitpunkten von 4, 8 und 12 Wochen nach der Operation
bewertet.
-
Untersuchungsverfahren
-
Am
Ende der Untersuchungsperiode werden die Tiere unter Verwendung
einer intravenösen
Barbiturat-Überdosis
getötet.
Die Ulna und der Radius werden sofort im Ganzen entnommen und in
eine in Salzlösung getränkte Windel
gegeben. Beide Ulnae werden makrophotographiert und Kontaktröntgenaufnahmen
werden gemacht, bevor die Weichgewebe vorsichtig von der Defekt-Stelle
wegpräpariert
werden. Eine wassergekühlte Säge wird
dann verwendet, um die Ulna in eine einheitliche Länge von
9 cm, mit dem Defekt in der Mitte der Testprobe zentriert, für die biomechanische
Untersuchungsbewertung zu schneiden.
-
Wenn
die Defektheilung, basierend auf der manuellen Manipulation, ausreichend
ist, werden die Proben auf Versagen in der Drehung auf einer hydraulischen
MTS-Testmaschine mit geschlossenem Kreislauf (Minneapolis, MN) getestet,
die mit Wegsteuerung bei einer konstanten Verdrängungsrate von 50 mm/min betrieben
wird. Jedes Ende des Knochensegments wird in einer zylindrischen
Aluminiummanschette befestigt und mit Methylmethacrylat zementiert.
Ein Ende wird fest fixiert und das andere wird gegen den Uhrzeigersinn gedreht.
Da die Hundeulna eine leichte Krümmung
aufweist, werden die Proben außermittig befestigt,
um die Rotation der Proben koaxial mit der der Testvorrichtung zu
belassen. Die Drehkraft wurde mit einem Hebelarm von 6 cm ausgeübt. Kraft-Winkel-Verschiebungskurven
wurden hergestellt, durch welche das Drehmoment und die Winkeldeformation
bis zum Versagen erhalten wurde, und die Energieabsorption bis zum
Versagen wird als das Gebiet unter der Belastungs—Verschiebungskurve
berechnet.
-
Sowohl
getestete als auch nicht-getestete Proben werden für eine histologische
Bewertung präpariert. Die
einzelnen Proben werden durch Eintauchen in eine 10% gepufferte
Formalinlösung
sofort nach der mechanischen Testung oder nach der Schnitterzeugung
in nicht-getesteten Proben fixiert. Auf einer wassergekühlten Diamantensäge werden
die Proben geteilt, indem die Proben entlang ihrer Längsachse
geteilt werden. Dieses Verfahren resultiert in zwei Teilen von jeder
Probe für
histologische Präparationen,
einschließlich nicht-entkalkter
geschliffener Schnitte und nicht-entkalkte Mikrotomschnitte. Die
histologischen Schnitte werden auf die Qualität der Vereinigung, das Aussehen
und die Qualität
des kortikalen Knochens und der Spongiosa und auf Knochen-Umformung
bewertet.
-
Ergebnisse
-
Es
wird erwartet, dass Fibrinkleber enthaltende, verbesserte Vorrichtungen
die mit irgendeiner der vorstehend erwähnten bevorzugten Matrizen
wie zum Beispiel Kollagen oder β-TCP
die Reparatur von segmentalen Defekten mit sowohl kritischer als
auch nicht-kritischer Größe fördern werden.
-
VII. Menschliche Klinische
Studien: Verfahren der Verwendung von verbesserten osteogenen Vorrichtungen
-
A. Reparatur von Knochendefekten: 1.
Test 1: Frische offene Tibiafraktur
-
Diese
Studie ist eine multizentrische, prospektive, randomisierte Studie
von Patienten mit frischen Frakturen der Tibia, die operative Intervention
an der Frakturstelle benötigen.
-
Einführung
-
Im
Moment gibt es weltweit jährlich
ungefähr
26 Millionen Frakturen. Der Hauptteil der Frakturen heilt ohne Komplikationen
und wird nicht als ein „Problem" angesehen. Es gibt
jedoch eine „Beeinflussung
der Lebensqualität" bei Patienten, die
nicht arbeiten können
oder daran gehindert sind, an normaler Aktivität teilzuhaben, nicht in der
Lage sind, wieder zu einer Aktivität zurückzukehren, oder, wenn sie
das tun, an fortbestehenden Schmerzen leiden. Patienten, besonders
in der westlichen Welt, erwarten zu diesen Problemen mehr und mehr
Lösungen.
-
Die
mit Frakturbehandlung verbundenen Kosten sind erstaunlich. 1988
kosteten Frakturen in den Vereinigten Staaten geschätzte $20
Milliarden. Der größte Teil,
ungefähr
44% oder $7,2 Milliarden, stand im Zusammenhang mit der Behandlung
von stationären
Patienten. In diesem Jahr wurden fast 900.000 Personen für Frakturen
in's Krankenhaus
eingewiesen, mit einer durchschnittlichen Aufenthaltsdauer von 8,8
Tagen für eine
Gesamtheit von 7,9 Millionen Tagen. Die Kosten für Pflegeheime lagen mit $2,8
Milliarden an zweiter Stelle und die Betreuung von ambulanten Patienten
mit $1,8 Milliarden an dritter Stelle.
-
Wenn
die ökonomischen
Auswirkungen von Frakturen in Zusammenhang mit der Beeinflussung
der Lebensqualität
betrachtet werden, gibt es tatsächlich
einen Bedarf für
die Verbesserung in den Behandlungsmethoden, insbesondere bei Frakturen,
die als potentiell problematisch betrachtet werden. Das sind Frakturen, die
aufgrund der Art der Verletzung oder um Wirtsprobleme abzuschwächen, zusätzliche
chirurgische Intervention benötigen
würden,
eine verlängerte
Zeit zur Heilung brauchen würden
und/oder eine völlige,
funktionelle Genesung verhindern könnten.
-
Die
nachstehend beschriebene Studie ist daher geplant, um die verbesserten
osteogenen Vorrichtungen als einen Heilungsbeschleuniger für neue Frakturen
in Menschen zu studieren, und als ein Mittel, den Bedarf nach einer
erforderlichen Intervention bei Heilungsproblemen nach der Operation
zu verringern, um den Heilungsprozess zu beschleunigen. Außerdem werden
bestimmte Patienten innerhalb dieser Studie mit verbesserten osteogenen
Vorrichtungen als einen Knochen-Transplantatersatz behandelt werden,
und zwar Patienten, die nach der Verletzung ein Knochentransplantat
benötigen,
oder in Fällen
von verzögerter
Heilung.
-
Wie
hierin in Erwägung
gezogen und vorstehend beschrieben, haben gegenwärtig bevorzugte Ausführungsformen
der verbesserten osteogenen Vorrichtungen eine Konsistenz, die durch
eine Nadel mit großem Gauge-Wert
injiziert werden kann oder durch einen offenen Einschnitt so platziert
werden können,
dass sie im Allgemeinen in einer blutigen Umgebung an ihrem Platz
verbleiben. Zusätzlich
zu konventionellerer Verpackung können die injizierbaren, verbesserten
osteogenen Vorrichtungen in Applikatoren/Spritzen verpackt werden,
die sofort verwendbar sind. Eine Vielzahl an Spritzen und Nadeln
kann hinzugefügt
werden, um die Anwendung zu individualisieren. Andere Ausführungsformen
werden auch durch die Zugabe von strahlungsundurchlässigen Komponenten,
wie sie vorher beschrieben wurden, strahlungsdurchlässig gemacht
werden.
-
Es
wird erwartet, dass die verbesserten osteogenen Vorrichtungen der
vorliegenden Erfindung (injizierbar und implantierbar) die Häufigkeit
von zusätzlichen
Interventionen vermindern, die Heilungsrate beschleunigen, die Lebensqualität und die
Geschwindigkeit der Rückkehr
zu normaler Aktivität
verbessern werden. Darüberhinaus
wird erwartet, dass die verbesserten osteogenen Vorrichtungen, die
hierin offenbart werden, in Frakturen von allen langen Knochen,
Schlüsselbein
und Schulterblatt verwendet werden, um die Heilung zu beschleunigen
und zu einer verminderten Häufigkeit
von Intervention (einschließlich
nochmaliger Operation), erhöhter
Heilungsgeschwindigkeit, erhöhter
Rate der Rückkehr
zu normaler Aktivität
und verminderter Sterblichkeit zu führen. Im Gegensatz zu gegenwärtig vorliegenden
Modalitäten
der Frakturreparatur gibt es keine biomechanische Anforderung bei
den verbesserten Vorrichtungen und Verfahren, die hierin offenbart werden.
-
Untersuchungsanordnung
-
Patienten
werden eine chirurgische Behandlung von offenen Frakturen der Tibia
benötigen,
welche nach einem Trauma erlangt wurde. Die Fraktur muss das Potential
haben, an der Frakturstelle ausreichend stabilisiert zu werden,
um Heilung zu gestatten. Die Patienten werden röntgenografischen Beweis der
Skelettreife zeigen.
-
Art der Behandlung
-
- Typ #1: Anfängliche
Verletzung bei ≤ 7
Tage bei definitivem Verschluss
- Typ #2: Bis zu 6 Wochen nach der anfänglichen Verletzung in Patienten,
die ein Knochentransplantat benötigen.
-
Typ
#1-Frakturen sind jene, die keine Knochentransplantation benötigen. Die
Patienten werden in einem 1:1-Verhältnis von Standardbehandlung
(Wundausschneidung der Frakturstelle, Reduktion und Stabilisierung),
welche die Kontrollgruppe sein wird, im Vergleich zu Standardbehandlung
mit OP-1-Vorrichtung mit und ohne einem Bindemittel wie zum Beispiel
Carboxymethylcellulose (CMC) willkürlich ausgewählt. In
bestimmten Patienten werden die Dosierungen von osteogenem Protein
OP-1 variieren. Wie vorstehend beschrieben, enthält eine gegenwärtig bevorzugte
Formulierung der verbesserten osteogenen Vorrichtung 2,5 mg OP-1/100g Kollagen/200
mg CMC. OP-1-Dosierungen werden von ½ bis maximal 4 × variieren;
der CMC-Gehalt wird von 100-300 mg variieren. Wie auch vorstehend
beschrieben, werden Variationen von Benetzungsmittelvolumina durch
den behandelnden Chirurgen/Arzt untersucht werden, um die gewünschte Konsistenz/Konfiguration
der Vorrichtung zu erzielen. Patienten aus der ersten Gruppe, bei
denen 6 Monate nach der Behandlung keine Heilung erfolgt ist, werden
wieder in einem 1:1 Verhältnis
von Knochentransplantation (Kontrolle) im Vergleich zu OP-1 willkürlich ausgewählt.
-
Typ
#2-Frakturen sind jene, die Knochentransplantation benötigen. Die
Patienten werden in einem 1:1-Verhältnis von Knochentransplantation
(Kontrolle) im Vergleich zu OP-1 willkürlich ausgewählt. Patienten aus
der ersten Gruppe, bei denen nach 6 Monaten nach der Behandlung
keine Heilung erfolt ist, werden von der Knochentransplantation
zu OP-1 und von OP-1 zur Knochentransplantation wechseln.
-
Untersuchungsplan
-
Die
Patienten werden für
ein Minimum von 1 Jahr nach der Behandlung beobachtet, um die Heilung zu
bewerten, mit einer Nachuntersuchung nach 24 Monaten, um den Status
zu bewerten.
-
Nachuntersuchungen
werden 2 Wochen, 4 Wochen und alle 4 Wochen bis zu 6 Monaten und
bei 8, 10 und 12 Monaten nach der Behandlung durchgeführt. Alle
Patienten werden zusätzliche
Nachuntersuchungs-Beurteilungen nach 24 Monaten haben, um die Gesamtgesundheit
und den Status der Frakturstelle zu bewerten. Die folgenden Bewertungen
werden durchgeführt:
Veränderungen
in physischer Untersuchung; Röntgenbilder;
klinische Schmerzbewertung; klinische Bewertung der Fähigkeit
ihr Gewicht zu tragen; klinische Funktionsbewertung; Bewertung der
Lebensqualität
(vor der Entlassung, 6 und 12 Monate); und Dokumentation von allen
Interventionen zur Beschleunigung/Förderung der Heilung (chirurgisch
und nicht chirurgisch) und Versagen/Ersatz von Hardware.
-
Es
wird erwartet, dass Frakturen, die mit verbesserten osteogenen Vorrichtungen
behandelt wurden, einen Beweis von beschleunigter Heilungsrate zeigen.
-
Außerdem wird
erwartet, dass die mit den verbesserten osteogenen Vorrichtung behandelten
Patienten zumindest die folgenden zusätzlichen Vorteile erfahren
werden:
- 1) Möglichkeit für verminderte Heilungszeit
mit schnellerer Wiederherstellung der Funktion, der Fähigkeit ihr
Gewicht zu tragen und Gehfähigkeit;
- 2) Möglichkeit
zur Verhinderung von verzögerter/schlechter/Nicht-Vereinigung;
- 3) Rückkehr
zu normalen Aktivitäten
früher/weniger
Zeitverlust von Arbeit/Schule;
- 4) Mögliche
Bewahrung vor weiterer Intervention/weiteren operativen Verfahren
zur
Beschleunigung der Heilung;
- 5) Weniger Hardwarekomplikationen; und
- 6) In jenen Patienten, die Knochentransplantation benötigen, den
Vorteil von keiner Operation an einer zweiten Stelle zur Knochenentnahme
mit damit in Zusammenhang stehender Sterblichkeit.
-
2. Test 2: Frische verschlossene
Diaphysenfraktur
-
Die
Reparatur von frischen verschlossenen Diaphysenfrakturen in menschlichen
Testpersonen wird unter Verwendung von verbesserten osteogenen Vorrichtungen
bewertet werden. Patienten werden genau gesagt durch Injektion der
Vorrichtung in die verschlossenen Defekt-Stellen mit injizierbaren,
verbesserten osteogenen Vorrichtungen behandelt werden. Es wird
erwartet, dass beschleunigte Reparatur des Defekts im Vergleich
zu Patienten beobachtet wird, die nicht mit verbesserten osteogenen
Vorrichtungen behandelt werden.
-
3. Andere Tests an Menschen
-
Es
wird erwartet, dass die Tests 1 und 2, die vorstehend dargelegt
wurden, unter Verwendung von verschiedenen Konfigurationen von verbesserten
osteogenen Vorrichtungen wiederholt werden, die Fibrinkleber enthalten.
Es wird ferner erwartet, dass solche Vorrichtungen die Knochenbildung
fördern
werden und in bestimmten Ausführungsformen
die Defektreparatur, im Vergleich zu unbehandelten Testpersonen,
beschleunigen.
-
B. Reparatur von osteochondralen
Defekten
-
1. Experiment 1: Osteochondritis
Dessicans
-
Osteochondrale
Defektmodelle unterstützen
die klinische Verwendung von rhOP-1, um Osteochondritis Dessicans
(OD) und Traumadefekte zu behandeln. OD ist eine Erkrankung, die
in lokalisierten Gebieten von osteochondralen Defekten resultiert.
Eine Ursache der Erkrankung kann ischämische Verletzung eines lokalisierten
Gebiets sein, aber seine genaue Ätiologie
ist unbekannt. In Patienten mit OD werden die betroffenen Gebiete
nicht-vaskulär,
mit anschließenden
Veränderungen
im darüberliegenden
Gelenkknorpel. Patienten, die an OD des Knies leiden, erleben Symptome
einschließlich
Blockierung des Gelenks, lokalisierten Schmerz, Schwellung und retropatellaren
Crepitus. Ein Experiment, das Patienten mit OD des Knies involviert, wird
durchgeführt,
um die Fähigkeit
der verbesserten osteogenen Vorrichtung gegen die der osteogenen
Standard-Vorrichtung bei der Reparatur von OD-Defekten zu vergleichen.
-
Gegenwärtig im
Fachgebiet bekannte Verfahren zu Behandlung von OD schließen die
Verwendung von sehr invasiven chirurgischen Techniken ein. In den
meisten Patienten mit reifem Skelett mit OD wird eine Operation
benötigt.
Chirurgische Techniken benötigen
arthroskopische Bohrung der intakten Läsion. Als ein Ergebnis müssen Patienten
während
der Operation die Verabreichung einer Vollnarkose durchmachen. Nach der
Operation müssen
die Patienten in der Bewegung ihrer Knie durch eine immobilisierende
Schiene ruhig gestellt werden und können, bis die Heilung nachgewiesen
ist, nicht ohne die Verwendung von Krücken gehen.
-
In
dieser Studie werden weniger invasive Techniken zur Behandlung von
OD durchgeführt.
Die Techniken beinhalten die Verwendung von verbesserten osteogenen
Vorrichtungen, die über
Injektion an die Defekt-Stelle verabreicht werden. Die Aktivität der verbesserten
osteogenen Vorrichtung in der Reparatur von OD wird mit der von
osteogener Standard-Vorrichtung verglichen.
-
Es
wird erwartet, dass Patienten, die mit der verbesserten osteogenen
Vorrichtung behandelt werden, die irgendeine der vorstehend erwähnten Matrizen
und Bindemittel enthält,
eine größere Befreiung
von den Symptomen der OD zeigen werden als jene, die mit der osteogenen
Standardvorrichtung behandelt werden. Patienten, die mit verbesserter
osteogener Vorrichtung behandelt werden, werden zumindest eine größere Verminderung
an Schmerzen, Schwellung und Arretieren des Knies erfahren als jene,
die mit der osteogenen Standard-Vorrichtung behandelt werden, wobei
das alles Indizien der Besserung und/oder Reparatur des Defekts
sind.
-
Äquivalente
-
Die
Erfindung kann in anderen spezifischen Formen verkörpert sein,
ohne von den wesentlichen Eigenschaften davon abzuweichen. Die vorhergehenden
Ausführungsformen
werden daher in jeder Hinsicht eher als illustrativ als limitierend
für die
hierin beschriebene Erfindung betrachtet. Der Geltungsbereich der
Erfindung wird daher eher durch die beigefügten Ansprüche als durch die vorangehende Beschreibung
angegeben und alle Veränderungen,
welche in die Bedeutung der Ansprüche fallen, sind daher vorgesehen,
dass sie hierin eingeschlossen sind.
-
-
-
-
-
-
-